题目内容
20.下列有关热化学方程式的叙述正确的是( )| A. | 已知2H2 (g)+O2(g)═2H2O(g )△H=-483.6kJ/mol,则H2的燃烧热为△H=-241.8kJ/mol | |
| B. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol | |
| C. | 反应NH3(g)+HCl(g)═NH4Cl (s)△H<0,该反应在任何温度下都可自发进行 | |
| D. | 已知C(s)+O2(g)═CO2(g)△H1;C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2,则△H1>△H2 |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧生成液态水;
B、依据酸碱中和热概念是强酸强碱稀溶液反应生成1mol水放出的热量计算分析;
C、反应能自发进行说明:△H-T△S<0,据反应的焓变和熵变符号来回答;
D、物质完全燃烧放出的热量多于不完全燃烧放出的热量,焓变是负数.
解答 解:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧生成液态水,由热化学方程式可知,氢气的燃烧热<-241.8kJ•mol-1,故A错误;
B、依据酸碱中和热概念是强酸强碱稀溶液反应生成1mol水放出的热量计算分析,含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,40g氢氧化钠完全反应放热57.4 kJ,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,故B正确;
C、反应能自发进行说明:△H-T△S<0,由方程式NH3(g)+HCl(g)═NH4Cl(s)可知该反应的△H<0<0,要使该反应在任何温度下都可自发进行,需要△S>0,但是该反应是熵减反应,故C错误;
D、碳单质完全燃烧放出的热量多于不完全燃烧放出的热量,根据焓变是负数,所以△H1<△H2,故D错误.
故选B.
点评 本题考查了反应自发性的判断、反应焓变的大小比较以及燃烧热和中和热的意义等知识,题目涉及的知识点较多,侧重于基础知识的综合考查,题目难度中等.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
10.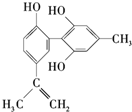 体育比赛中坚决反对运动员服用兴奋剂,倡导公平竞赛.某种兴奋剂P的结构简式如图所示,下列有关该物质的说法中正确的是( )
体育比赛中坚决反对运动员服用兴奋剂,倡导公平竞赛.某种兴奋剂P的结构简式如图所示,下列有关该物质的说法中正确的是( )
 体育比赛中坚决反对运动员服用兴奋剂,倡导公平竞赛.某种兴奋剂P的结构简式如图所示,下列有关该物质的说法中正确的是( )
体育比赛中坚决反对运动员服用兴奋剂,倡导公平竞赛.某种兴奋剂P的结构简式如图所示,下列有关该物质的说法中正确的是( )| A. | 兴奋剂P遇FeCl3溶液显紫色,说明P是苯酚的同系物 | |
| B. | 兴奋剂P能使酸性KMnO4溶液的紫色褪去,说明P分子中存在碳碳双键 | |
| C. | 兴奋剂P在一定条件下可以发生取代、加成、加聚、氧化、还原、消去等反应 | |
| D. | 1mol P分别与浓溴水和H2反应时最多消耗的Br2和H2分别为4mol和7mol |
8.把V mL含有MgSO4和K2SO4的混合溶液分成五等份,一份加入含a mol NaOH的溶液,恰好使Mg2+完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使SO42-完全沉淀为BaSO4.则原混合溶液中K+的浓度为( )
| A. | $\frac{5000(2b-a)}{V}$mol/L | B. | $\frac{5(2b-a)}{V}$mol/L | C. | $\frac{(2b-a)}{V}$mol/L | D. | $\frac{1000(2b-a)}{V}$mol/L |
15. MOH和ROH两种一元碱,常温下其水溶液分别加水稀释时,pH变化如下图,下列说法正确的是( )
MOH和ROH两种一元碱,常温下其水溶液分别加水稀释时,pH变化如下图,下列说法正确的是( )
 MOH和ROH两种一元碱,常温下其水溶液分别加水稀释时,pH变化如下图,下列说法正确的是( )
MOH和ROH两种一元碱,常温下其水溶液分别加水稀释时,pH变化如下图,下列说法正确的是( )| A. | 在x点,由HO电离出的c (H+)相等,c (M+)=c (R+) | |
| B. | 稀释前,c (ROH)=10 c (MOH) | |
| C. | 稀释前的ROH与等体积pH=1的H2SO4混合后所得溶液显酸性 | |
| D. | 等体积等浓度的MOH和HCl混合后,溶液中离子浓度大小关系:c (Cl-)>c (M+)>c (OH-)>c (H+) |
5.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol,下列说法中正确的是( )
| A. | 浓硫酸和NaOH溶液反应,生成 l mol水时放热57.3 kJ | |
| B. | 含l molH2SO4的稀硫酸与足量稀NaOH溶液中和后,放热为57.3 kJ | |
| C. | 1L 0.l mol/L CH3COOH与1L 0.l mol/L NaOH溶液反应后放热为5.73 kJ | |
| D. | 1L 0.l mol/L HNO3与 1L 0.l mol/L NaOH溶液反应后放热为 5.73 kJ |
12.能正确表示下列反应的离子方程式是( )
| A. | 甲酸钠溶液和盐酸反应:HCOO-+H+═HCOOH | |
| B. | 硫化钠的第一步水解:S2-+2H2O?H2S+2OH- | |
| C. | 醋酸钡溶液和硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸氢钠的水解:HCO3-+H2O═H3O++CO32- |
9.在中和滴定实验中用到的仪器,只需用蒸馏水洗净不能用待盛放液体润洗的是( )
| A. | 酸式滴定管 | B. | 碱式滴定管 | C. | 移液管 | D. | 锥形瓶 |
10.下列有机化合物中均含有杂质.除去这些杂质的方法和对应原理都正确的是( )
| 选项 | 杂质方法 | 除杂方法 | 原理 |
| A | 苯中含苯酚杂质 | 加入浓溴水,过滤 | 苯酚能与溴水反应生成白色沉淀 |
| B | 乙酸乙酯中含乙酸杂质 | 加饱和Na2CO3溶液洗涤,分液 | 乙酸乙酯在饱和Na2CO3溶液中的溶解度小且乙酸与Na2CO3反应 |
| C | 除去溴苯中的苯 | 蒸馏 | 苯的沸点比溴苯高 |
| D | 乙醇中含乙酸杂质 | 加入饱和Na2CO3溶液洗涤,分液 | 乙酸能与Na2CO3反应 |
| A. | A | B. | B | C. | C | D. | D |