题目内容
16.经测定H2O2为二元极弱酸,其酸性比碳酸弱且有漂白性.它在碱性溶液中极不稳定,易分解生成H2O和O2.若向Na2O2中通入干燥的CO2的气体,Na2O2与CO2并不反应,它与潮湿的CO2反应放出气体后的液体仍可使品红试液颜色有所减退.(1)写出H2O2在其水溶液中的电离方程式:H2O2?H++HO2-.
(2)用化学方程式表示Na2O2和潮湿的CO2气体反应的过程:①Na2O2+CO2+H2O=Na2CO3+H2O2②2H2O2$\frac{\underline{\;OH-\;}}{\;}$2H2O+O2.
分析 (1)过氧化氢为弱电解质,部分电离,用可逆号;
(2)过氧化钠与潮湿的二氧化碳反应生成碳酸钠和过氧化氢;过氧化氢分解生成水和氧气.
解答 解:(1)过氧化氢为弱电解质,部分电离,用可逆号,电离方程式:H2O2?H++HO2-;
故答案为:H2O2?H++HO2-;
(2)过氧化钠与潮湿的二氧化碳反应生成碳酸钠和过氧化氢,化学方程式:Na2O2+CO2+H2O=Na2CO3+H2O2;过氧化氢分解生成水和氧气,化学方程式:2H2O2$\frac{\underline{\;OH-\;}}{\;}$2H2O+O2;
故答案为:Na2O2+CO2+H2O=Na2CO3+H2O2;2H2O2$\frac{\underline{\;OH-\;}}{\;}$2H2O+O2.
点评 本题考查了电解质电离方程式书写、化学方程式的书写,明确过氧化氢为二元极弱酸及过氧化钠与二氧化碳反应过程是解题关键,题目难度不大.

练习册系列答案
相关题目
7. 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
(1)下列△H表示物质燃烧热的是△H4、△H5;表示物质中和热的是△H6.(填“△H1”、“△H2”和“△H3”等)
A.2H2(g)+O2(g)=2H2O(l)△H1
B.C(s)+1/2O2(g)=CO(g)△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)=CO2(g)△H4
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H7
(2)已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是C.
A.C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=+2akJ/mol
B.C2H6(g)+$\frac{7}{2}$/2O2(g)=2CO2(g)+3H2O(g)△H=-2akJ/mol
C.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-4akJ/mol
D.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=-4akJ/mol
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关(键能可以简单地理解为断开1mol化学键时所需吸收的能量),如表是部分化学键的键能数据:
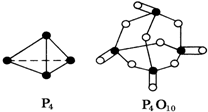
已知白磷(P4)的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则如表中a=433.75.
(4)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ/mol.
 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.(1)下列△H表示物质燃烧热的是△H4、△H5;表示物质中和热的是△H6.(填“△H1”、“△H2”和“△H3”等)
A.2H2(g)+O2(g)=2H2O(l)△H1
B.C(s)+1/2O2(g)=CO(g)△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)=CO2(g)△H4
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H7
(2)已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是C.
A.C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=+2akJ/mol
B.C2H6(g)+$\frac{7}{2}$/2O2(g)=2CO2(g)+3H2O(g)△H=-2akJ/mol
C.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-4akJ/mol
D.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=-4akJ/mol
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关(键能可以简单地理解为断开1mol化学键时所需吸收的能量),如表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能KJ/mol | 197 | 360 | 499 | a |
(4)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ/mol.
11.常根据物质的组成、状态、性能等对物质进行分类.下列分类中,前者能够包含后者的是( )
| A. | 酸性氧化物、非金属氧化物 | B. | 胶体、分散系 | ||
| C. | 含氧酸、酸 | D. | 化合物、非电解质 |
1.类比归纳是学习化学的重要方法,对如下类比的说法正确的是( )
| A. | NO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色 | |
| B. | MgO、Al2O3都是高熔点离子化合物,都能用作耐热材料 | |
| C. | CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | CuO、Fe2O3都是不溶于水的碱性氧化物,都是黑色粉末 |
8.下列化学用语书写正确的是( )
| A. | 乙酸乙酯的结构简式:CH3CH2COOCH3 | |
| B. | 丙烯的键线式 | |
| C. | 乙醇的结构式: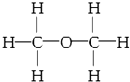 | |
| D. | 乙烯的结构简式:CH2=CH2 |
5.下列关于Na2O2的叙述正确的是( )
| A. | Na2O2是淡黄色固体,久置于空气中变成Na2O | |
| B. | Na2O2与水的反应中,Na2O2只作氧化剂 | |
| C. | 用0.1mol Na2O2与足量水反应转移的电子的物质的量为0.2mol | |
| D. | Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |
6.短周期元素甲、乙、丙、丁的原子序数依次增大,甲位于第VA族,乙原子的核外电子数比甲原子多1,乙与丁同族,丙原子最外层电子数与电子层数相等.下列判断正确的是( )
| A. | 离子半径:丁>丙>乙 | |
| B. | 81号元素铊与丙元素处同主族,则铊的最高价氧化物对应水化物呈两性 | |
| C. | 电解法可以用乙与丙形成的化合物制得丙单质 | |
| D. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 |
 粗铜的电解精炼如图所示.在粗铜的电解过程中,粗铜板应是图中电极c(填图中的字母);在电极d上发生的电极反应式为Cu2++2e-═Cu.
粗铜的电解精炼如图所示.在粗铜的电解过程中,粗铜板应是图中电极c(填图中的字母);在电极d上发生的电极反应式为Cu2++2e-═Cu.