题目内容
10.将固体NH4I置于密闭容器中,在某温度下发生下列反应:①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g)
当反应达到平衡时,c(H2)=1mol/,c(HI)=4mol/L,则反应①的化学平衡常数为( )
| A. | 36 | B. | 24 | C. | 20 | D. | 10 |
分析 当反应达到平衡时,c(H2)=1mol/,c(HI)=4mol/L,则
②2HI(g)?H2(g)+I2(g)
2mol/L 1mol/L
①NH4I(s)?NH3(g)+HI(g)
6mol/L 4mol/L
K为生成物浓度幂之积与反应物浓度幂之积的比,固体不能代入K中,以此来解答.
解答 解:当反应达到平衡时,c(H2)=1mol/,c(HI)=4mol/L,则
②2HI(g)?H2(g)+I2(g)
2mol/L 1mol/L
①NH4I(s)?NH3(g)+HI(g)
6mol/L 4mol/L
则反应①的化学平衡常数K=6mol/L×4mol/L=24(mol/L)2,
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握反应中平衡浓度与K的关系为解答的关键,侧重分析与计算能力的考查,注意平衡时氨气的浓度,题目难度不大.

练习册系列答案
相关题目
1.以下变化明显吸热的是( )
| A. | 盐酸与NaOH溶液混合 | B. | 固体NaCl加入水中 | ||
| C. | 固体NH4Cl加入水中 | D. | 固体CaO加入水中 |
5.关于下列四个图象的说法中不正确的是( )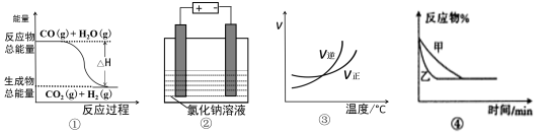

| A. | 图①表示可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0 | |
| B. | 图②表示用惰性电极电解足量氯化钠溶液.一段时间后,两极上可收集到相等体积的气体 | |
| C. | 图③表示可逆反应:A2(g)+3B2(g)?2AB3(g)△H<0 | |
| D. | 图④表示压强对可逆反应2A(g)+B(g)?3C(g)+D(s)的影响,乙压强大 |
15.A、B、C、D、E为原子序数依次增大的短周期主族元素,A原子的最外层电子数为内层电子数的2倍,B原子的M电子层有1个电子,C的氢氧化物既能与强酸反应又能与强碱反应,D的最高正价和最低负价的代数和为4,E在同周期主族元素中原子半径最小.下列叙述错误的是( )
| A. | 元素C位于周期表中第三周期ⅢA族 | |
| B. | 电解熔融化合物CE3可制取单质C | |
| C. | D的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | 化合物B2D2中既含离子键又含非极性共价键 |
2.下列有关实验操作能达到实验目的或得出相应结论的是( )
| 选项 | 实验目的 | 实验操作及现象 |
| A | 检验1-溴丙烷中含有溴 | 将1-溴丙烷与足量氢氧化钠溶液混合加热,冷却后加硝酸银溶液,得沉淀 |
| B | 验证样品中一定含有苯酚 | 向样品溶液中滴加氯化铁溶液后显紫色 |
| C | 验证蔗糖没有水解 | 在蔗糖溶液中加入稀硫酸,水浴加热一段时间后,加入少量新制Cu(OH)2悬浊液,加热后未出现砖红色沉淀 |
| D | 证明蛋白质的变性是不可逆的 | 向蛋白质溶液中滴加CuSO4溶液,有固体析出,过滤,向固体中加足量水,固体不溶解 |
| A. | A | B. | B | C. | C | D. | D |
19.下列指定反应的离子方程式正确的是( )
| A. | FeSO4酸性溶液中加入H2O2:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| B. | NaOH溶液吸收工业制硝酸的尾气:NO+NO2+2OH-═2NO3-+H2O | |
| C. | NH4HCO3溶液中滴加足量NaOH溶液:NH4++OH-═NH3•H2O | |
| D. | KIO3溶液氧化KI的酸性溶液:IO3-+5I-+3H2O═3I2↓+6OH- |