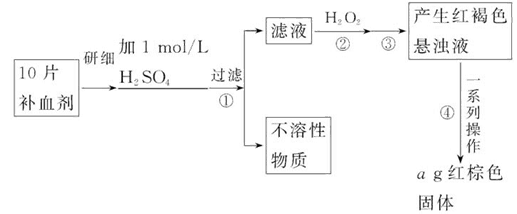
题目内容
某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下: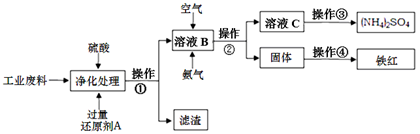
回答下列问题:
(1)滤渣的成分为 ,操作①的名称为 。
(2)上图溶液B中所发生反应的离子方程式为 。
(3)实验要求向溶液B中通入过量的空气,证明通入空气过量的方法是 。
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要 、 。
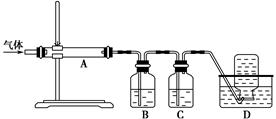
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。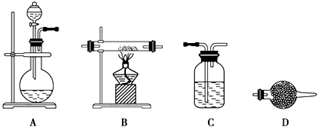
①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→_____→_____→_____→D(除D装置外,其它装置不能重复使用),最后D装置中所加药品为____________,其作用是___________________。
②点燃B处酒精灯之前必须进行的操作是____________________。
(1)Fe、Cu;过滤(2)4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3↓
(3)取上层清液少许于试管中,加入酸性高锰酸钾溶液,酸性高锰酸钾溶液的紫色不变(无变化)。(4)蒸发皿、玻璃棒
(5)①A—C—B—D—D;碱石灰;防止空气中水蒸气进入前面装置中②检验氢气的纯度。
解析试题分析:(1)向含有硫酸亚铁和硫酸铜的工业废料中加入过量的稀硫酸来溶解该混合物,防止硫酸亚铁和硫酸铜的水解。然后加入过量的还原铁粉,发生反应:CuSO4+Fe=FeSO4+Cu, Fe+H2SO4=FeSO4+H2↑.所以过滤得到的滤渣主要成分是置换出来的Cu和过量的Fe粉。滤液的成分是FeSO4。(2)向滤液中加入足量的氨气,发生反应:FeSO4+2NH3+2H2O=Fe(OH)2↓+ (NH4)2SO4. 再通足量的空气,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3.总反应方程式为:4FeSO4+O2+8NH3+10H2O=4Fe(OH)3↓+ 4(NH4)2SO4.,离子方程式为:4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3↓。将4Fe(OH)3过滤出来,洗涤干净,然后灼烧,4Fe(OH)3分解产生铁红—氧化铁和水。(3)实验要求向溶液B中通入过量的空气,证明通入空气过量的方法是取上层清液少许于试管中,加入酸性高锰酸钾溶液,酸性高锰酸钾溶液的紫色无变化,就证明无Fe2+,即空气足量把Fe2+完全变为Fe3+。(4)溶液C的主要成分是(NH4)2SO4。要得到(NH4)2SO4晶体,在操作③第一步需要的仪器有酒精灯、铁架台、蒸发皿、玻璃棒。(5)①利用A装置发生反应Zn+H2SO4=ZnSO4+H2↑制H2,再通过C装置用浓硫酸来干燥氢气,在把干燥的氢气通过装有CuO的硬质玻璃管的B装置,使氢气发生氧化还原反应。然后通过装有无水硫酸铜的干燥管D来检验反应的产物,最后要再通过装有碱石灰的干燥管D来防止空气中水蒸气进入前面装置中②检验氢气的纯度。因此装置连接顺序是A—C—B—D—D。②由于氢气是可燃性的气体。在点燃B处酒精灯之前必须检验氢气的纯度,否则会发生爆炸。
考点:考查以含硫酸亚铁和硫酸铜的工业废料来生产(NH4)2SO4、铁红的过程及原理和验证H2的还原性并检验其氧化产物的实验装置的选择、连接、注意事项等知识。

上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
| A.稀硫酸 | B.氨水 | C.氢氧化钠溶液 | D.高锰酸钾溶液 |
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是_____________________________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为______________________________。

 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
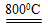 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑