题目内容
4. 中国科学家屠呦呦获拉斯克一狄贝基临床医学研究奖,以表彰她发现了一种药物--青蒿素,分子式为C15H22O5,它是由菊科植物在低温条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构筒式如图1所示.下列有关青蒿素的说法错误的是( )
中国科学家屠呦呦获拉斯克一狄贝基临床医学研究奖,以表彰她发现了一种药物--青蒿素,分子式为C15H22O5,它是由菊科植物在低温条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构筒式如图1所示.下列有关青蒿素的说法错误的是( )| A. | 青蒿素耐高温且易溶于水,不易溶于乙醚、乙酸乙酯等有机溶剂 | |
| B. | 青蒿素分子内的1个过氧基团是对付疟原虫的核心基团 | |
| C. | 提炼过程中可能用到萃取等物理方法 | |
| D. | 药效比青蒿素高10倍的双氢青蒿素(见图2)分子式为C15H24O5 |
分析 A.在低温下提取,说明不能耐高温;
B.含有过氧键,具有强氧化性;
C.提炼过程用到乙醚萃取分离;
D.根据结构简式判断.
解答 解:A.由题给信息可知,在低温下提取,说明不能耐高温,故A错误;
B.含有过氧键,具有强氧化性,可用于杀菌消毒,故B正确;
C.提炼过程用到乙醚萃取分离,为物理方法,故C正确;
D.药效比青蒿素高10倍的双氢青蒿素( ),C形成4个化学键,O只能形成2个化学键,则化学式为C15H24O5,故D正确;
),C形成4个化学键,O只能形成2个化学键,则化学式为C15H24O5,故D正确;
故选A.
点评 本题考查有机物的结构性质,为高频考点,把握结构中的环状及酯的性质为解答的关键,侧重分析能力和知识迁移应用能力的考查,注意有机物分子式由结构中化学键分析,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列有关说法正确的是( )
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0、△S<0 | |
| B. | 滴加Cu(NO3)2溶液可以加快Zn与稀H2SO4反应制备氢气的速率 | |
| C. | 氯水中加入少量CaCO3粉末,可以提高漂白能力 | |
| D. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
19.下列解释过程或事实的方程式不正确的是( )
| A. | 检验Fe2+:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ | |
| B. | 打磨过的铝片与NaOH溶液反应产生气体:2Al+2OH-═2AlO2-+H2↑ | |
| C. | NaOH溶液不能保存在玻璃塞的试剂瓶中:SiO2+2OH-═SiO32-+H2O | |
| D. | 白色的Fe(OH)2在空气中变为红褐色:4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
9.不能直接用乙烯为原料制取的物质是( )
| A. | CH3CH2Cl | B. | CH2Cl-CH2Cl | C. |  | D. |  |
16.下列物质中,能与稀盐酸反应的有( )
| A. | Cu | B. | CaCO3 | C. | Zn | D. | AgNO3 |
13. 研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).
研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).
(1)已知一定压强下,该反应在温度升高时,CH3OCH3(g)的浓度增大,则反应的焓变△H>0,熵变△S<0(分别填“>”、“<”、或“=”).
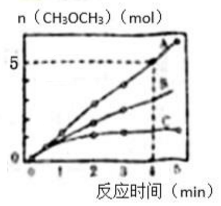
(2)相同条件下,在体积为2L的密闭容器内选用不同的催化剂,生成物二甲醚CH3OCH3的量随时间变化如图所示.
①图中0-4min内的反应速率v(CO2)=1.25mol•(L•min)-1.该温度下平衡常数的表达式为$\frac{{c(C{H_3}OC{H_3})}}{{{c^2}(C{O_2}){c^6}({H_2})}}$.
②下列有关说法正确的是ABC(填字母序号).
A.反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C)
B.升高温度能使反应速率加快,是因为活化分子百分数增大
C.单位时间内消耗CO2与生成H2的数目为2:1时,说明反应已经达到平衡
D.增大压强,平衡正向移动,平衡常数K值增大
(3)温度下,在体积可变的密闭容器中,改变起始时各物质的起始投料量,在不同的压强下,平衡时生成物二甲醚CH3OCH3(g)的物质的量如表所示:
①P1>P2(填“>”、“<”或“=”);判断理由为压强增大,平衡向正反应方向移动,从而导致生成物的量增大.
②X1=0.05mol.
③P2下,III中CH3OCH3的平衡转化率为96%.
 研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).
研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).(1)已知一定压强下,该反应在温度升高时,CH3OCH3(g)的浓度增大,则反应的焓变△H>0,熵变△S<0(分别填“>”、“<”、或“=”).
(2)相同条件下,在体积为2L的密闭容器内选用不同的催化剂,生成物二甲醚CH3OCH3的量随时间变化如图所示.
①图中0-4min内的反应速率v(CO2)=1.25mol•(L•min)-1.该温度下平衡常数的表达式为$\frac{{c(C{H_3}OC{H_3})}}{{{c^2}(C{O_2}){c^6}({H_2})}}$.
②下列有关说法正确的是ABC(填字母序号).
A.反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C)
B.升高温度能使反应速率加快,是因为活化分子百分数增大
C.单位时间内消耗CO2与生成H2的数目为2:1时,说明反应已经达到平衡
D.增大压强,平衡正向移动,平衡常数K值增大
(3)温度下,在体积可变的密闭容器中,改变起始时各物质的起始投料量,在不同的压强下,平衡时生成物二甲醚CH3OCH3(g)的物质的量如表所示:
| 序号 | 起始投料量不同的压强下, 平衡CH3OCH3(g)的量不同的压强 | P1 | P2 | P3 |
| I | 2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
| II | 1.0molCO2 3.0molH2 | X1 | Y1 | Z1 |
| III | 1.0mol CH3OCH3 3.0mol H2O | X2 | Y2 | Z2 |
②X1=0.05mol.
③P2下,III中CH3OCH3的平衡转化率为96%.
14.美国化学文摘社(CAS)的物质数据库中收录的物质已超过1亿种.下列有关物质的说法正确的是( )
| A. | 物质均由原子或分子构成 | |
| B. | 已知的大部分物质属于有机物 | |
| C. | 食品加工中应严禁使用人工合成的物质 | |
| D. | 干冰、可燃冰属于同种物质 |