题目内容
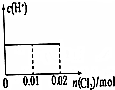
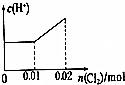
14.已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且产物的成分与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )| A. | 某温度下,反应后c(Cl-):c(ClO-)=6,则溶液中c(ClO-):c(ClO3-)=1 | |
| B. | 参加反应的氯气的物质的量等于0.5amol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:$\frac{1}{2}$amol<n<$\frac{5}{6}$amol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{1}{6}$amol |
分析 A.设n(ClO-)=1mol,反应后c(Cl-):c(ClO-)=6,则n(Cl-)=6mol,根据电子转移守恒计算n(ClO3-),据此计算判断;
B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH);
C.氧化产物只有KClO3时,转移电子最多,氧化产物只有KClO时,转移电子最少,根据电子转移守恒及钾离子守恒计算;
D.氧化产物只有KClO3时,其物质的量最大,结合C中计算判断.
解答 解:A.设n(ClO-)=1mol,反应后c(Cl-):c(ClO-)=6,则n(Cl-)=6mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即:5×n(ClO3-)+1×1mol=1×6mol,解得:n(ClO3-)=1mol,故溶溶液中c(ClO-):c(ClO3-)=1:1,故A正确;
B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH)=amol,故参加反应的氯气的物质的量为:n(Cl2)=$\frac{1}{2}$n(KOH)=0.5a mol,故B正确;
C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)=$\frac{1}{6}$n(KOH)=$\frac{1}{6}$a mol,转移电子最大物质的量为:$\frac{1}{6}$a mol×5=$\frac{5}{6}$a mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),故:n(KClO)=$\frac{1}{2}$n(KOH)=$\frac{1}{2}$a mol,转移电子最小物质的量=$\frac{1}{2}$a mol×1=$\frac{1}{2}$a mol,则反应中转移电子的物质的量n的范围为:$\frac{1}{2}$a mol≤n≤$\frac{5}{6}$a mol,故C错误;
D.氧化产物只有KClO3时,其物质的量最大,由C中计算可知:n最大(KClO3)=$\frac{1}{6}$n(KOH)=$\frac{1}{6}$a mol,故D正确;
故选C.
点评 本题考查氧化还原反应计算,题目难度中等,注意电子转移守恒及极限法的应用,试题培养了学生的分析、理解能力及化学计算能力.

| A. | Ba2+、Fe3+、OHˉ、SO42ˉ | B. | Mg2+、Na+、Clˉ、SO42ˉ | ||
| C. | NH4+、Mg2+、NO3-、OHˉ | D. | H+、K+、NO3-、CO32ˉ |
| A. | 不锈钢 | B. | 干冰 | C. | 碘酒 | D. | 空气 |

| A. | 实验Ⅰ:制备少量氧气 | |
| B. | 实验Ⅱ:比较酸性强弱:H2SO4>H2CO3>H2SiO3 | |
| C. | 实验Ⅲ:分离溴的苯溶液 | |
| D. | 实验Ⅳ:观察纯碱的焰色反应 |
| A. | 标准状况下,11.2LO2和O3组成的混合气体含有原子数为NA | |
| B. | 0.1mol•L-1Na2SO4溶液中含有Na+的个数为0.2NA | |
| C. | 常温常压下,1.7gNH3中含有的电子数目为NA | |
| D. | 5.6gFe和足量的盐酸完全反应失去电子数为0.3NA |
| A. | 铁 | B. | 氢氧化钾 | C. | 酒精 | D. | 空气 |
| A. | 235 g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子( ${\;}_{0}^{1}$n)数为10NA | |
| B. | 60 g丙醇中存在的共价键总数为10 NA | |
| C. | 25 g质盆分数为68%的H202的水溶液中含氧原子数为NA | |
| D. | 2.0 g H218O与D2O的混合物中所含中子数为NA |