题目内容
根据热化学方程式:S(g)+O2(g)=SO2(g)ΔH=-QkJ·mol-1( Q>0),则下列分析正确的是
Q>0),则下列分析正确的是
A.1molS(g)与1molO2(g)的总能量比1molSO2(g)的总能量低QkJ
B.1molS(g)与1molO2(g)反应生成1molSO2(g)放出QkJ的能量
C.S(s)+O2(g)=SO2(g)ΔH<-QkJ·mol-1
D.1个S(g)与1个O2(g)完全反应可放出QkJ的能量
练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
通常人们把拆开1 mol某化学键所吸收的能量或形成1 m ol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知
ol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知
化学健 | H-H | Cl-Cl | H-Cl |
键能 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
则下列热化学方程式不正确的是
A.1/2 H2(g)+1/2Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1
C.2HCl(g)=H2(g)+Cl2(g) ΔH=+183 kJ·mol-1
D.1/2 H2(g)+1/2Cl2(g)=HCl(g) ΔH=+91.5 kJ·mol-1


 C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是 D.①④
D.①④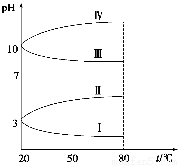
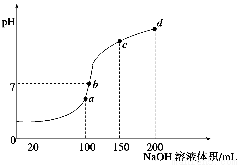
 xC(g),ΔH<0;在2 min时反应达到平衡状态(温度不变) 剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),ΔH<0;在2 min时反应达到平衡状态(温度不变) 剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白: 乙醇含有的分子数为NA
乙醇含有的分子数为NA