题目内容
向NaOH溶液中通入CO2,得到的物质有多种可能,请完成下列假设,并回答后续问题.
假设1:Na2CO3和NaHCO3
假设2:Na2CO3
假设3:
假设4:
若向上述反应后的溶液中加入1mol/L HCl.
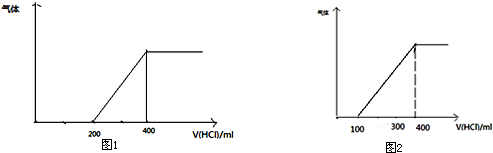
(1)产生的气体如图1所示:则该溶液溶质的成分为 ,其物质的量为
(2)产生的气体如图2所示:则该溶液溶质的成分是上述假设 (填1或2、3、4),其对应成分及物质的量为 .
假设1:Na2CO3和NaHCO3
假设2:Na2CO3
假设3:
假设4:
若向上述反应后的溶液中加入1mol/L HCl.
(1)产生的气体如图1所示:则该溶液溶质的成分为
(2)产生的气体如图2所示:则该溶液溶质的成分是上述假设

考点:化学方程式的有关计算
专题:图示题,计算题
分析:CO2与NaOH反应为:①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H2O,
当n(CO2):n(NaOH)≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
当
<n(CO2):n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
当n(CO2):n(NaOH)≤
,反应按②进行,等于
时,CO2、NaOH恰好反应生成Na2CO3;小于
时,生成Na2CO3,NaOH有剩余;
(1)由反应:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,可知碳酸钠转化为碳酸氢钠与碳酸氢钠完全反应消耗HCl相等,由图1可知,从200ml到400ml为碳酸氢钠与盐酸反应,前后两部分消耗盐酸相等,故溶质为碳酸钠,结合方程式计算其物质的量;
(2)图2中从100ml到400ml为碳酸氢钠与盐酸反应,前后两部分消耗盐酸体积之比为1:3<1:1,故溶质为碳酸钠、碳酸氢钠,结合方程式计算其物质的量.
当n(CO2):n(NaOH)≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
当
| 1 |
| 2 |
当n(CO2):n(NaOH)≤
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
(1)由反应:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,可知碳酸钠转化为碳酸氢钠与碳酸氢钠完全反应消耗HCl相等,由图1可知,从200ml到400ml为碳酸氢钠与盐酸反应,前后两部分消耗盐酸相等,故溶质为碳酸钠,结合方程式计算其物质的量;
(2)图2中从100ml到400ml为碳酸氢钠与盐酸反应,前后两部分消耗盐酸体积之比为1:3<1:1,故溶质为碳酸钠、碳酸氢钠,结合方程式计算其物质的量.
解答:
解:CO2与NaOH反应为:①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H2O,
当n(CO2):n(NaOH)≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
当
<n(CO2):n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
当n(CO2):n(NaOH)≤
,反应按②进行,等于
时,CO2、NaOH恰好反应生成Na2CO3;小于
时,生成Na2CO3,NaOH有剩余;
故答案为:Na2CO3,NaOH;NaHCO3;
(1)由反应:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,可知碳酸钠转化为碳酸氢钠与碳酸氢钠完全反应消耗HCl相等,由图1可知,从200ml到400ml为碳酸氢钠与盐酸反应,前后两部分消耗盐酸相等,故溶质为Na2CO3,
200mL溶液中HCl的物质的量=0.2L×1mol/L=0.2mol,由Na2CO3+HCl=NaHCO3+NaCl可知,碳酸钠的物质的量=n(HCl)=0.2mol,
故答案为:Na2CO3;0.2mol;
(2)图2中从100ml到400ml为碳酸氢钠与盐酸反应,前后两部分消耗盐酸体积之比为1:3<1:1,故溶质为碳酸钠、碳酸氢钠,为假设3,
100mL溶液中HCl的物质的量=0.1L×1mol/L=0.1mol,则:
Na2CO3+HCl=NaHCO3+NaCl
0.1mol 0.1mol 0.1mol
故原溶液中n(Na2CO3)=0.1mol,
300mL溶液中HCl的物质的量=0.3L×1mol/L=0.3mol,
NaHCO3+HCl=NaCl+CO2↑+H2O
0.3mol 0.3mol
故原溶液中n(NaHCO3)=0.3mol-0.1mol=0.2mol
故答案为:3;n(Na2CO3)=0.1mol、n(NaHCO3)=0.2mol.
当n(CO2):n(NaOH)≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
当
| 1 |
| 2 |
当n(CO2):n(NaOH)≤
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:Na2CO3,NaOH;NaHCO3;
(1)由反应:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,可知碳酸钠转化为碳酸氢钠与碳酸氢钠完全反应消耗HCl相等,由图1可知,从200ml到400ml为碳酸氢钠与盐酸反应,前后两部分消耗盐酸相等,故溶质为Na2CO3,
200mL溶液中HCl的物质的量=0.2L×1mol/L=0.2mol,由Na2CO3+HCl=NaHCO3+NaCl可知,碳酸钠的物质的量=n(HCl)=0.2mol,
故答案为:Na2CO3;0.2mol;
(2)图2中从100ml到400ml为碳酸氢钠与盐酸反应,前后两部分消耗盐酸体积之比为1:3<1:1,故溶质为碳酸钠、碳酸氢钠,为假设3,
100mL溶液中HCl的物质的量=0.1L×1mol/L=0.1mol,则:
Na2CO3+HCl=NaHCO3+NaCl
0.1mol 0.1mol 0.1mol
故原溶液中n(Na2CO3)=0.1mol,
300mL溶液中HCl的物质的量=0.3L×1mol/L=0.3mol,
NaHCO3+HCl=NaCl+CO2↑+H2O
0.3mol 0.3mol
故原溶液中n(NaHCO3)=0.3mol-0.1mol=0.2mol
故答案为:3;n(Na2CO3)=0.1mol、n(NaHCO3)=0.2mol.
点评:本题考查混合物的有关计算,关键是清楚发生的反应根据图中盐酸的体积确定溶质,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数.B原子核内质子数和中子数相等.下列叙述不正确的是( )
| A | C | |
| B |
| A、三种元素的原子半径的大小顺序是:B>C>A |
| B、A元素最高价氧化物对应的水化物具有强氧化性 |
| C、B元素的氧化物、氢化物的水溶液都呈酸性 |
| D、C元素是非金属性最强的元素 |
常温下,下列不发生反应的一组物质是( )
①硅与NaOH溶液 ②硅与盐酸 ③硅与氢氟酸
④二氧化硅与碳酸钠 ⑤二氧化硅与NaOH溶液 ⑥二氧化硅与浓硝酸.
①硅与NaOH溶液 ②硅与盐酸 ③硅与氢氟酸
④二氧化硅与碳酸钠 ⑤二氧化硅与NaOH溶液 ⑥二氧化硅与浓硝酸.
| A、①②④ | B、③④⑥ |
| C、②⑤⑥ | D、②④⑥ |
已知反应:①101kPa时,C(s)+
O2(g)=CO(g);△H1=-110.5kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H2=-57.3kJ/mol,下列结论正确的是( )
| 1 |
| 2 |
| A、若碳的燃烧热用△H3来表示,则△H3<△H1 |
| B、若碳的燃烧热用△H3来表示,则△H3>△H1 |
| C、稀硫酸与稀NaOH溶液反应的中和热△H=-57.3kJ/mol |
| D、浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
 标志垃圾箱的是
标志垃圾箱的是 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).