题目内容
4.根据下列实验操作、现象级及相应结论都正确的是( )| 选项 | 实验操作 | 现象 | 结论 |
| A | 向1mL 0.1mol/LAgNO3溶液中滴加2滴0.1mol/LNaCl溶液,振荡后,再滴加2滴0.1mol/LKI溶液 | 先产生白色沉淀,后产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 加热盛有浓硫酸和可抽动铜丝的试管,并将产生的气体通入到品红溶液中 | 品红溶液褪色,且试管中只产生蓝色溶液 | 浓硫酸具有强氧化性 |
| C | 向丙烯醇(HOCH2CH=CH2)中滴入少量酸性高锰酸钾溶液 | 溶液紫红色褪去 | 丙烯醇中含有碳碳双键 |
| D | 碳酸钠溶液中滴加稀硫酸后,将产生的气体通入到硅酸钠溶液中 | 产生白色沉淀 | 非金属性:S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硝酸银过量,不能比较溶度积大小;
B.在加热条件下,Cu和浓硫酸发生反应生成硫酸铜、二氧化硫和水,该反应中部分S元素化合价不变、不变S元素化合价降低;
C.醇羟基和碳碳双键都能被酸性高锰酸钾溶液氧化;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸.
解答 解:A.该实验中硝酸银过量,不能体现沉淀的转化,所以不能比较溶度积大小,故A错误;
B.在加热条件下,Cu和浓硫酸发生反应生成硫酸铜、二氧化硫和水,该反应中部分S元素化合价不变、不变S元素化合价降低,浓硫酸体现强氧化性和酸性,故B错误;
C.醇羟基和碳碳双键都能被酸性高锰酸钾溶液氧化,所以不能用酸性高锰酸钾溶液检验碳碳双键,应该用溴水,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,碳酸钠溶液中滴加稀硫酸后,将产生的气体通入到硅酸钠溶液中,产生白色沉淀,说明硫酸和碳酸钠反应生成二氧化碳,二氧化碳、水和硅酸钠反应生成硅酸,则酸性:硫酸>碳酸>硅酸,则非金属性S>C>Si,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及非金属性强弱判断、官能团检验、元素化合物性质、溶度积大小比较等知识点,明确实验原理及物质性质是解本题关键,易错选项是AB,注意A中硝酸银如果不足量时可以比较,题目难度不大.

练习册系列答案
相关题目
12. 某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行试验并得到下表实验结果:
某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行试验并得到下表实验结果:
分析上述数据,回答下列问题:
(1)实验1中电流由B极流向A极(填“A”或“B”)
(2)实验4中电子由B极 流向A极,表明负极是铝电极(填“镁”或“铝”)
(3)实验3 表明B
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是会发生的
(4)分析上表有关信息,下列说法不正确的是A
A.相对活泼的金属一旦做负极
B.失去电子的电极是负极
C.烧杯中的溶液,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
 某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行试验并得到下表实验结果:
某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行试验并得到下表实验结果:| 序号 | A | B | 烧杯中的液体 | 灵敏电流计指针是否偏转 |
| 1 | Zn | Cu | 稀硫酸 | 有 |
| 2 | Zn | Cu | 乙醇 | 无 |
| 3 | Cu | C | 氯化钠溶液 | 有 |
| 4 | Mg | Al | 氢氧化钠溶液 | 有 |
(1)实验1中电流由B极流向A极(填“A”或“B”)
(2)实验4中电子由B极 流向A极,表明负极是铝电极(填“镁”或“铝”)
(3)实验3 表明B
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是会发生的
(4)分析上表有关信息,下列说法不正确的是A
A.相对活泼的金属一旦做负极
B.失去电子的电极是负极
C.烧杯中的溶液,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
19.化学与生活、生产、可持续发展密切相关,下列说法中正确的是( )
| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 淀粉和纤维素都是高分子化合物,且都是非电解质 | |
| C. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| D. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 |
9.用NA表示阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 常温下,1 L 0.1 mol•L-1 的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,2.24 L己烷中共价键数目为1.9NA | |
| C. | 室温下,28.0 g乙烯和丁烯的混合气体中含有的碳原子数为2NA | |
| D. | 足量Fe与标准状况下22.4 L Cl2充分反应,转移的电子数为2NA |
16.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:

根据以上信息回答下列问题:
(1)生产过程中X的化学式为Fe.
(2)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.实际生产中SO2要适当过量,原因可能是提高Cu2+的还原速率,同时可以防止生成的Cu+被空气氧化(答一点即可).
(4)实验探究pH对CuCl产率的影响如下表所示:
析出CuCl晶体最佳pH为2,当pH较大时CuCl产率变低原因是Cu2+水解程度增大,反应生成CuCl减少,产率减小.调节pH时,不能(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是硝酸会与产品CuCl发生反应.
(5)氯化亚铜的定量分析:
①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈标准溶液滴定.已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+.三次平行实验结果如下(平行实验结果相差不能超过1%):
则样品中CuCl的纯度为95.5%(结果保留三位有效数字).

根据以上信息回答下列问题:
(1)生产过程中X的化学式为Fe.
(2)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.实际生产中SO2要适当过量,原因可能是提高Cu2+的还原速率,同时可以防止生成的Cu+被空气氧化(答一点即可).
(4)实验探究pH对CuCl产率的影响如下表所示:
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(5)氯化亚铜的定量分析:
①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈标准溶液滴定.已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+.三次平行实验结果如下(平行实验结果相差不能超过1%):
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
14.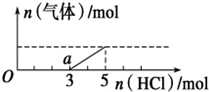 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | a点溶液中c (HCO3-)>c (CO32-) | |
| C. | 标准状况下,通入CO2的体积为44.8L | |
| D. | 原NaOH溶液的物质的量浓度为5mol/L |