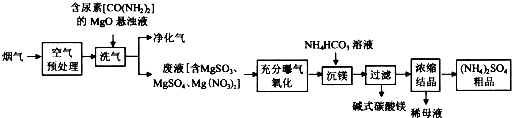
题目内容
19.维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.(1)测定目的:测定某品牌软包装橙汁中维生素C的含量.
(2)测定原理:C6H8O6+I2→C6H6O6+2H++2I-.
(3)实验用品:
①仪器:(自选,略).
②试剂:指示剂淀粉溶液(填名称)、浓度为7.5×10-3 mol•L-1的标准碘溶液、蒸馏水等.
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用.
②打开橙汁包装,目测:颜色--橙黄色,澄清度--好.用酸式滴定管(填仪器名称)向锥形瓶中量入20.00mL待测橙汁,滴入2滴指示剂.
③用左手控制滴定管的活塞(填部位),右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,直到滴定终点,滴定至终点的现象是最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色.
(5)数据记录与处理:若滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是990mg•L-1.
(6)问题讨论:
①滴定时能否剧烈摇动锥形瓶?为什么?不能,防止液体飞溅影响测定结果,还防止维生素C被氧化.
②从分析数据看,此软包装橙汁是否是纯天然橙汁不是(填“是”或“不是).
分析 (3)②根据碘能使淀粉变蓝色选择试剂;
(4)②橙汁呈酸性,用酸式滴定管取用;
③滴定时左手控制活塞;根据反应的原理,当出现溶液变蓝色且半分钟内不褪色时,维生素C已全部参加了反应;
(5)根据反应C6H8O6+I2→C6H6O6+2H++2I-及题中碘的质量为:254g/mol×0.015L×7.5×10-3mol•L-1=28.575mg,可以计算出橙汁中维生素C的含量;
(6)①滴定时不能剧烈摇动锥形瓶防止液体飞溅,还防止维生素C被氧化;
②新鲜橙汁中维生素C的含量在500mg/L左右分析判断.
解答 解:(3)②利用I2氧化维生素C,根据碘使淀粉显蓝色的性质,应选择淀粉作指示剂,
故答案为:淀粉溶液;
(4)②橙汁呈酸性,用酸式滴定管取用,向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂;
故答案为:酸式滴定管;
③在滴定时左手控制活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化直到滴定终点;根据反应的原理,当出现溶液变蓝色时,维生素C已全部参加了反应,滴定终点现象为:最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色,
故答案为:活塞;锥形瓶中溶液颜色的变化;最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色;
(5)15ml标准碘溶液含有碘的质量为:254g/mol×0.015L×7.5×10-3mol•L-1=28.575mg
设20.0mL待测橙汁中维生素C的质量为X
C6H8O6+I2→C6H6O6+2H++2I-
176 254
X 28.575mg
$\frac{176}{254}$=$\frac{X}{28.575mg}$
解得:X=19.8mg
则1L中含维生素C的质量为:19.8mg×1000ml/20ml=990mg,
所以,则此橙汁中维生素C的含量是990mg/L,
故答案为:990;
(6)①滴定时不能剧烈摇动锥形瓶防止液体飞溅影响且防止维生素C被氧化;
故答案为:不能,防止液体飞溅影响测定结果,还防止维生素C被氧化;
②新鲜橙汁中维生素C的含量在500mg/L左右分析判断,从分析数据看此橙汁中维生素C的含量是990mg/L,此软包装橙汁不是纯天然橙汁,可能采取的做法是将维生素C作为添加剂;
故答案为:不是.
点评 本题考查了橙汁中维生素C的含量,属于综合实验题,完成本题时要注意题中数据的处理,合理进行误差的分析等,本题难度中等.

 对可逆反应:2A(g)+B(s)?3C(s)+2D(g);△H>0.如图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:
对可逆反应:2A(g)+B(s)?3C(s)+2D(g);△H>0.如图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;
②加入催化剂;
③加压;
④升温;
⑤减少C
符合图示的条件是( )
| A. | ②③ | B. | ①② | C. | ③④ | D. | ④⑤ |
| 现象 | 解释 |
| 该反应的化学方程式 | |
| A. | 氧化钠可用于呼吸面具中作为氧气的来源 | |
| B. | 氧化还原反应的实质是元素化合价是否变化 | |
| C. | 铁制容器可以贮运稀硝酸 | |
| D. | 雷电为自然界固氮提供了条件 |
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末;有气泡产生,说明氯水中含有H+ | |
| D. | 氯水中加入氢氧化钠溶液,氯水的黄绿色消失,说明氯水中含有HClO |
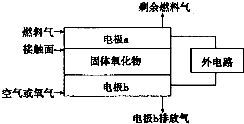 已知氮元素有多种化合价,如:-3、0、+1、+2、+3、+4、+5.
已知氮元素有多种化合价,如:-3、0、+1、+2、+3、+4、+5.(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系:
| 硝酸 | 硝酸浓度大于10mol/L | 硝酸浓度为6.6~10mol/L、加热 | 硝酸浓度为6.6~10mol/L |
| 还原产物 | NO2 | NO2 | NO2 |
| 硝酸 | 硝酸浓度为0.1~6.6mol/L、加热 | 硝酸浓度0.1~6.6mol/L | 硝酸浓度0.1mol/L |
| 还原产物 | NO | NO2、N2 | NH4NO3 |
(2)以氨作为燃料的固体氧化物(含有O2-,接触面可让O2-通过)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体.其工作原理如图所示
①负极为a(选填“a”或“b”).
②该电池工作时的总反应为4NH3+3O2=2N2+6H2O.
③固体氧化物作为电池工作的电解质,O2-移动方向为由电极b向电极a移动(选填“由电极a向电极b”或“由电极b向电极a”).
④该电池工作时,在图中所给的接触面上发生的电极反应为:2NH3+3O2--6e-=N2+3H2O.
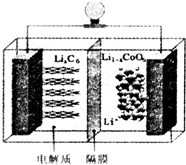 随着各地“限牌”政策的推出,电动汽车成为汽车族的“新宠”.某电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车族的“新宠”.某电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 放电时,正极锂的化合价未发生改变 | |
| B. | 充电时Li+移动方向:右室→左室 | |
| C. | 放电时负极的电极反应式:LixC6-xe-═C6+xLi+ | |
| D. | 充电时阳极的电极反应式:Li1-xCoO2+xLi++xe-═LiCoO2 |