题目内容
9.锌是一种重要的金属,锌及其化合物有着广泛的应用.①指出锌在周期表中的位置:第四周期,第ⅡB族,基态Zn原子的电子排布式1s22s22p63s23p63d104s2或[Ar]3d104s2.
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.葡萄糖分子中碳原子杂化方式有sp2、sp3.
分析 ①根据元素对应的原子结构判断元素在周期表中的位置;元素的原子结构示意图中,电子层数与其周期数相等,根据价电子数及电子所在轨道判断族序数;
②葡萄糖里有两种碳原子,葡萄糖是无羟基醛,一种是以sp3杂化,一种是以sp2杂化.
解答 解:(1)①Zn是30号元素,根据核外电子排布规律可知,Zn的电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,电子层数等于周期数,位于周期表第四周期,
其3d、4s能级上电子是其价电子,价电子排布式为3d104s2,所以位于第ⅡB族,
故答案为:四;ⅡB;1s22s22p63s23p63d104s2或[Ar]3d104s2;
②葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳),
故答案为:sp2、sp3.
点评 本题考查了基态原子的核外电子排布式以及原子杂化方式的判断,题目难度不大,解题时要熟悉常见元素在周期表中的位置,掌握价层电子对互斥理论的熟练应用.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
19.下列说法正确的是( )
| A. | 离子化合物NH4Cl中既存在离子键,又存在极性共价键 | |
| B. | H2S的电子式是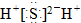 | |
| C. | 化学键包括离子键、共价键、氢键等 | |
| D. | LiOH、NaOH、KOH的碱性逐渐减弱 |
20.对于可逆反应:2NO2(g)?N2O4(g)正反应放热.下列判断正确的是( )
| A. | 升高温度,混合气体颜色变浅 | |
| B. | 平衡时,NO2浓度必定等于N2O4浓度的两倍 | |
| C. | 平衡时,反应不在进行 | |
| D. | 平衡时,各组分浓度不再随时间的延长而发生变化 |
17.下列说法或表示方法正确的是( )
| A. | 将0.5molN2和1.5molH2充入一密闭容器中充分反应,放出热量19.6KJ则该热化学方程式为N2(g)+3 H2(g)?2NH3(g)△H=-39.2 KJ•mol-1 | |
| B. | 由C(石墨)=C(金刚石);△H=+1.9 kJ/mol,可知金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 | |
| D. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol |
4.用萃取法从碘水中分离碘,所用萃取剂应具有的性质是( )
①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂.
①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂.
| A. | ①②⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①③④ |
14.2C+O2=2CO,2CO+O2=2CO2都是放热反应.下列说法不正确的是( )
| A. | 12gC与16gO2所具有的总能量一定高于28gCO所具有的能量 | |
| B. | 56gCO所具有的能量大于88gCO2所具有的总能量 | |
| C. | 12gC和32gO2所具有的总能量大于44gCO2所具有的总能量 | |
| D. | 将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多 |
1.下表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)由实验可推知,反应物的总能量>产物的总能量(填“<”“>”“=”).
(2)实验4和5表明,固体的表面积 对反应速率有影响,固体的表面积越大 反应速率越快,能表明同一规律的实验还有1、2(填实验序号);
(3)仅表明反应物浓度对反应速率产生影响的实验有1、3、4、6、8 或 2、5 (填实验序号);
(4)本实验中影响反应速率的其他因素还有溶液的温度,其实验序是6和7.
| 实验序号 | 金属质量/g | 金属状态 | c(H2SO4)/mol.L-1 | v(H2SO4)/mL | 溶液温度反应前/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
(1)由实验可推知,反应物的总能量>产物的总能量(填“<”“>”“=”).
(2)实验4和5表明,固体的表面积 对反应速率有影响,固体的表面积越大 反应速率越快,能表明同一规律的实验还有1、2(填实验序号);
(3)仅表明反应物浓度对反应速率产生影响的实验有1、3、4、6、8 或 2、5 (填实验序号);
(4)本实验中影响反应速率的其他因素还有溶液的温度,其实验序是6和7.
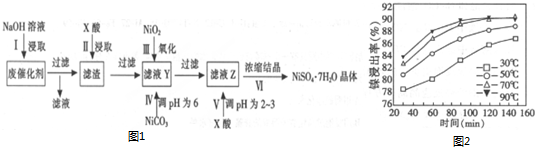
20.某油脂化工厂的含镍废催化剂主要含有Ni,还含有Al、Fe的单质及氧化物,其他是不溶杂质.现用该废催化剂制取NiSO4•7H2O,流程如图1:
部分阳离子以氢氧物形式完全沉淀时的pH如下:
回答下列问题:
(1)第1步加入NaOH溶液的目的是除去Al、Al2O3和油脂等杂质.
(2)“酸浸”时所加入的X酸是硫酸(填化学式).保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图2,“酸浸”的适宜温度与时间分别是C(填选项字母).
A.30℃、30min B.90℃、150min C.70℃、120min
(3)第V步调pH为2~3的目的是(请结合化学用语和平衡移动原理解释)溶液中存在水解平衡Ni2++2H2O?Ni(OH)2+2H+,增大氢离子浓度平衡逆向进行避免浓缩过程中水解生成沉淀.
(4)工业上以铝和NiOOH为电极,NaOH溶液为电解液制成电池.放电时,NiOOH转化为Ni(OH)2,该电池正极反应式是NiO(OH)+H2O+e-═Ni(OH)2+OH-.
(5)已知:2Mg(s)+O2(g)=2Mg(s)△H1=-2075kJ/mol
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)△H2=+84.6kJ/mol
MgH2(s)+$\frac{1}{2}$O2(g)=MgO(s)+H2(g)△H3=-963kJ/mol
含镍储氢材料(Mg2NiH4)释放氢气和Mg2Ni的热化学方程式是Mg2NiH4(s)=Mg2Ni(s)+2H2(g)△H=+64.4KJ/mol.
(6)在含镍废催化剂中,Ni、Al和Fe的质量分数分别是29.5%、31%和5.6%.a kg含镍废催化剂按上述流程转化,第Ⅱ步加入cmol/L的X酸bL,酸浸后的滤液Y不含Fe3+,滤液Z中残留的酸忽略不计,则第Ⅳ步应加入NiCO30.119(cb-5.5a)kg.

部分阳离子以氢氧物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)第1步加入NaOH溶液的目的是除去Al、Al2O3和油脂等杂质.
(2)“酸浸”时所加入的X酸是硫酸(填化学式).保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图2,“酸浸”的适宜温度与时间分别是C(填选项字母).
A.30℃、30min B.90℃、150min C.70℃、120min
(3)第V步调pH为2~3的目的是(请结合化学用语和平衡移动原理解释)溶液中存在水解平衡Ni2++2H2O?Ni(OH)2+2H+,增大氢离子浓度平衡逆向进行避免浓缩过程中水解生成沉淀.
(4)工业上以铝和NiOOH为电极,NaOH溶液为电解液制成电池.放电时,NiOOH转化为Ni(OH)2,该电池正极反应式是NiO(OH)+H2O+e-═Ni(OH)2+OH-.
(5)已知:2Mg(s)+O2(g)=2Mg(s)△H1=-2075kJ/mol
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)△H2=+84.6kJ/mol
MgH2(s)+$\frac{1}{2}$O2(g)=MgO(s)+H2(g)△H3=-963kJ/mol
含镍储氢材料(Mg2NiH4)释放氢气和Mg2Ni的热化学方程式是Mg2NiH4(s)=Mg2Ni(s)+2H2(g)△H=+64.4KJ/mol.
(6)在含镍废催化剂中,Ni、Al和Fe的质量分数分别是29.5%、31%和5.6%.a kg含镍废催化剂按上述流程转化,第Ⅱ步加入cmol/L的X酸bL,酸浸后的滤液Y不含Fe3+,滤液Z中残留的酸忽略不计,则第Ⅳ步应加入NiCO30.119(cb-5.5a)kg.