题目内容
9.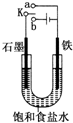 某课外活动小组同学用如图装置进行实验,试回答下列问题:
某课外活动小组同学用如图装置进行实验,试回答下列问题:①若开始时开关K与a连接,则铁发生电化学腐蚀中的吸氧腐蚀.
②若开始时开关K与b连接,则总反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
③若A极产生标准状况下2.24L气体,则电路中通过的电子为0.2mol.
分析 若开始时开关K与a连接,则形成原电池反应,为铁的吸氧腐蚀;
若开始时开关K与b连接,形成电解池装置,石墨为阳极,发生氧化反应生成氯气,铁为阴极,发生还原反应生成氢气和氢氧化钠,以此解答.
解答 解:①开始时开关K与a连接,是原电池,铁为负极,发生氧化反应,失去电子生成亚铁离子,电极方程式为Fe-2e-=Fe2+,A极上氧气得电子被还原,电极方程式为O2+2H2O+4e-=4OH-,为铁的吸氧腐蚀;
故答案为:吸氧;
②若开始时开关K与b连接,则电解饱和食盐水生成氢氧化钠、氢气和氯气,总反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
③若标准状况下Fe极产生2.24L氢气,即0.1mol氢气,由2H++2e-=H2↑可知转移0.2mol电子,
故答案为:0.2.
点评 本题综合原电池和电解质知识,侧重于学生的分析能力和电化学知识的综合应用,注意解题时要注意分析电极反应及生成物,难度中等.

练习册系列答案
相关题目
19.下列依据相关实验得出的结论正确的是( )
| A. | 同温同浓度Na2CO3和Na2SiO3水溶液的pH前者小于后者,则碳的非金属性强于硅 | |
| B. | 向淀粉溶液中加入稀硫酸,加热几分钟,冷却后加新制Cu(OH)2悬浊液,加热,无砖红色沉淀,则淀粉没有水解成葡萄糖 | |
| C. | 向无色溶液中加入氯水,再加CCl4,振荡静置后CCl4层呈紫色,则原溶液中含I- | |
| D. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液中一定含有CO32-或HCO3- |
20.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(甲醛) | 水、浓硫酸 | 洗气 |
| C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| D | 淀粉胶体(氯化钠溶液) | 蒸馏水 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
17. 香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示:下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示:下列有关香叶醇的叙述正确的是( )
 香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示:下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示:下列有关香叶醇的叙述正确的是( )| A. | 香叶醇的分子式为C10H18O | B. | 不能使溴的四氯化碳溶液褪色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生加成反应不能发生取代反应 |
14. 如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )
如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )
 如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )
如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
1.下列关于元素化合价的说法正确的是( )
| A. | 短周期中所有主族元素的最高化合价都等于其主族序数 | |
| B. | 所有元素都有正化合价和负化合价,它们的绝对值之和等于8 | |
| C. | 大多数非金属元素的负化合价等于该元素的原子最外层达到8电子稳定结构所需得到的电子数 | |
| D. | 偶数主族元素的化合价一定都是偶数,奇数主族元素的化合价一定都是奇数 |
18.在科学实验和工农业生产中,所使用的一定量的溶液一般都是量取它的体积,而较少称量它的质量.在溶液中发生的化学反应,反应物和生成物的物质的量也存在一定的比例关系、因此我们引入一个新的物理量-物质的量浓度来建立物质的量和溶液体积的关系.认真分析物质的量浓度的概念及其定义式并思考,下列溶液中溶质的物质的量浓度为1mol/L的是( )
| A. | 将40gNaOH溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L10mol/L的浓盐酸与9L水混合 | |
| D. | 将10gNaOH溶解于水中配成250mL溶液 |
20.下列互为同位素的是( )
| A. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | B. | 金刚石和石墨 | ||
| C. | 乙烷和丙烷 | D. | T2O和D2O |
 一定条件下,密闭容器中发生反应:N2(g)+H2(g)?2NH3(g),NH3和H2的物质的量n随时间t变化的关系如图所示.图象中处于平衡状态的点是( )
一定条件下,密闭容器中发生反应:N2(g)+H2(g)?2NH3(g),NH3和H2的物质的量n随时间t变化的关系如图所示.图象中处于平衡状态的点是( )