题目内容
室温时,0.1 mol·L-1的HA溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,有关叙述正确的是
- A.原HA溶液中,c(H+)=c(OH-)+c(A-)
- B.当滴入少量的NaOH,促进了HA的电离,溶液的pH降低
- C.当恰好完全中和时,溶液呈中性
- D.当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+)
A
试题分析:设HA的电离程度为x,则其变化浓度为0.1x mol·L-1,根据各组分的变化浓度之比等于系数之比可知,溶液中c(H+)="0.1x" mol·L-1,由pH=3可知,溶液中c(H+)=10ˉ3mol·L-1,所以0.1x =10ˉ3,x=1%,说明HA是弱酸。根据电荷守恒原理可知,c(H+)=c(OH-)+c(A-) ,故A正确;加入的NaOH与H+易反应,导致溶液中c(H+)减小,HA的电离平衡右移,促进HA的电离,但溶液的酸性减弱或pH增大,故B错误;HA是弱酸,NaOH是强碱,二者恰好完全中和时生成强碱弱酸盐NaA和H2O,根据盐类水解的规律可知,强碱弱酸盐溶液显弱碱性,故C错误;根据物料守恒原理可知,NaOH过量时HA不足,则溶液中c(Na+)一定大于c(A-),故D错误。
考点:考查水溶液中的离子平衡,涉及溶液中粒子浓度大小、电离平衡和溶液的酸碱性等知识。
试题分析:设HA的电离程度为x,则其变化浓度为0.1x mol·L-1,根据各组分的变化浓度之比等于系数之比可知,溶液中c(H+)="0.1x" mol·L-1,由pH=3可知,溶液中c(H+)=10ˉ3mol·L-1,所以0.1x =10ˉ3,x=1%,说明HA是弱酸。根据电荷守恒原理可知,c(H+)=c(OH-)+c(A-) ,故A正确;加入的NaOH与H+易反应,导致溶液中c(H+)减小,HA的电离平衡右移,促进HA的电离,但溶液的酸性减弱或pH增大,故B错误;HA是弱酸,NaOH是强碱,二者恰好完全中和时生成强碱弱酸盐NaA和H2O,根据盐类水解的规律可知,强碱弱酸盐溶液显弱碱性,故C错误;根据物料守恒原理可知,NaOH过量时HA不足,则溶液中c(Na+)一定大于c(A-),故D错误。
考点:考查水溶液中的离子平衡,涉及溶液中粒子浓度大小、电离平衡和溶液的酸碱性等知识。

练习册系列答案
相关题目
化学中图象可以直观地描述化学反应的进程或结果,下列图象描述正确的是( )
A、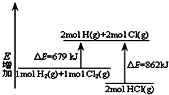 表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183 kJ?mol-1 | B、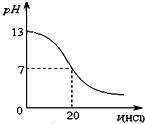 表示室温时用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液,溶液pH随加入酸体积变化 | C、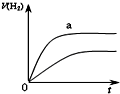 表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | D、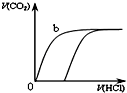 表示10 mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1mol/L HCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |