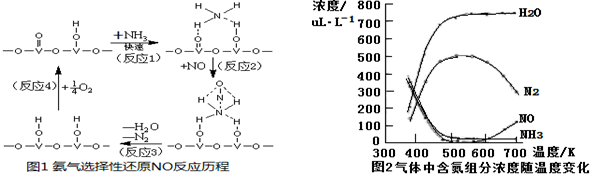
题目内容
20.在一定条件下,下列可逆反应达到化学平衡:H2(g)+I(g)?2HI(g);△H<0,要使混合气体的紫色加深,可以采取的方法是( )| A. | 保持体积不变加入H2 | B. | 压缩体积至原来的一半 | ||
| C. | 降低温度 | D. | 加入催化剂 |
分析 要使混合气体的颜色加深,应使c(I2)增大,可使平衡向逆反应方向移动,缩小容器的体积平衡不动浓度增大,升高温度逆向进行等,据此进行解答.
解答 解:A.保持体积不变加入H2,平衡向着正向移动,碘单质的浓度减小,混合气体的颜色变浅,故A错误;
B.减小体积,即增大压强,平衡不移动,但c(I2)增大,混合气体的颜色加深,故B正确;
C.反应是放热反应,降低温度,平衡向正向移动,c(I2)减小,混合气体的颜色变浅,故C错误;
D.催化剂不影响化学平衡,则加入催化剂不会使混合气体的紫色加深,故D错误;
故选B.
点评 本题考查了化学平衡的影响因素,题目难度不大,明确影响化学平衡的因素为解答关键,B为易错点,注意增大压强后平衡向着正向移动,但是各组分的浓度都会增大,试题培养了学生的灵活应用能力.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
8.已知:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-Q1kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol;
H2O(g)═H2O(l)△H=-Q3kJ/mol
(1)C2H2的燃烧热为Q1/2kJ/mol
(2)写出H2燃烧热的热化学方程式H2(g)+1/2O2(g)═H2O(l)△H=-(1/2Q2+Q3)kJ/mol
(3)常温下,取体积比为4:1的C2H2和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为(2Q1+0.5Q2+Q3)kJ
(4)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2、H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)?CH3(OH)(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如下:
由此计算:△H1=kJ/mol.已知△H2=-58kJ/mol,则△H3=kJ/mol.
2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol;
H2O(g)═H2O(l)△H=-Q3kJ/mol
(1)C2H2的燃烧热为Q1/2kJ/mol
(2)写出H2燃烧热的热化学方程式H2(g)+1/2O2(g)═H2O(l)△H=-(1/2Q2+Q3)kJ/mol
(3)常温下,取体积比为4:1的C2H2和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为(2Q1+0.5Q2+Q3)kJ
(4)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2、H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)?CH3(OH)(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O |  | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
15.在硫酸的工业生产过程中,欲提高SO2的反应速率和转化率,下列措施可行的是( )
| A. | 向装置中通入氮气且保持体积不变 | |
| B. | 向装置中通入稍过量氧气且保持体积不变 | |
| C. | 添加更多的催化剂 | |
| D. | 降低温度,及时转移SO3 |
5.一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子.
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在.
设计实验证实如下:
①盐酸溶解Al2O3薄膜的离子方程式是6H++Al2O3=2Al3++3H2O.
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
a.浅棕色气体是NO2.
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
1Al+1NO3-+4H+═1Al3++1NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.
重新设计实验证实如下:
为确认“刺激性气味”气体,进行如下实验:用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝.
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(5)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.习题中的无色溶液一定能大量存在的是Na+和OH-.
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在.
设计实验证实如下:
| 装置 | 现象 |
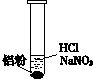 | ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 ⅲ.试管变热,溶液沸腾 |
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
1Al+1NO3-+4H+═1Al3++1NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.
重新设计实验证实如下:
| 装置 | 现象 |
 | ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,有刺激性气味 |
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(5)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.习题中的无色溶液一定能大量存在的是Na+和OH-.
12.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称为:2,6-二甲基-5-乙基庚烷 的名称为:2,6-二甲基-5-乙基庚烷 | |
| B. | 丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 | |
| C. | 大气污染物氟利昂-12的化学式是CF2Cl2具有正四面体结构 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
9.一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)?CO2(g)+H2(g),部分数据见表(表中t2>t1),说法错误的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
| A. | 反应在t1min末的速率为v(H2)=0.2/t mol•L-1•min-1 | |
| B. | 平衡时水蒸气的转化率为66.67% | |
| C. | 该温度下反应的平衡常数为l | |
| D. | 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时水蒸气的转化率为33.33% |
10.已知mg硫酸铁中含有a个Fe3+,则阿伏加德罗常数可以表示为( )
| A. | $\frac{200a}{m}$mol-1 | B. | $\frac{200m}{a}$mol-1 | C. | $\frac{2m}{a}$mol-1 | D. | $\frac{2a}{m}$mol-1 |
 利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.
利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.