题目内容
向1.00L 0.3mol?L-1 NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,有关该溶液的说法正确的是( )
| A、溶质仅含NaHCO3 |
| B、c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
考点:离子浓度大小的比较
专题:
分析:向1L 0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,则增重的8.8g为二氧化碳的质量,物质的量为0.2mol,发生反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,由于n(CO2):n(NaOH)=2:3=1:1.5,介于1:1~1:2之间,所以两个反应都发生,所得溶液中溶质为Na2CO3和NaHCO3,结合物料守恒与电荷守恒判断.
解答:
解:向1L 0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,则增重的8.8g为二氧化碳的质量,物质的量为0.2mol,发生反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,由于n(CO2):n(NaOH)=2:3=1:1.5,介于1:1~1:2之间,所以两个反应都发生,所得溶液中溶质为Na2CO3和NaHCO3,
A.通过以上分析知,溶质是碳酸氢钠和碳酸钠,故A错误;
B.由碳元素守恒可知c(HCO3-)+c(CO32-)+c(H2CO3)=0.2mol/L,溶液中c(Na+)=0.3mol/L,所以
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故B错误;
C.碳酸根离子、碳酸氢根离子都水解,而钠离子不水解,所以其混合溶液呈碱性,则c(OH-)>c(H+),碳酸根离子水解程度大于碳酸氢根离子,所以c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D正确;
故选D.
A.通过以上分析知,溶质是碳酸氢钠和碳酸钠,故A错误;
B.由碳元素守恒可知c(HCO3-)+c(CO32-)+c(H2CO3)=0.2mol/L,溶液中c(Na+)=0.3mol/L,所以
| 2 |
| 3 |
C.碳酸根离子、碳酸氢根离子都水解,而钠离子不水解,所以其混合溶液呈碱性,则c(OH-)>c(H+),碳酸根离子水解程度大于碳酸氢根离子,所以c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D正确;
故选D.
点评:本题考查根据方程式计算、离子浓度的比较,难度中等,判断二氧化碳与氢氧化钠的反应是解题关键,注意选项中离子浓度比较中物料守恒、电荷守恒的运用.

练习册系列答案
相关题目
下列关于化石燃料的加工说法正确的是( )
| A、石油裂化主要得到乙烯 |
| B、石油分馏是化学变化,可得到汽油、煤油 |
| C、煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 |
| D、石油的裂解可提高汽油等轻质油的质量和产量 |
阿魏酸在食品、医药等方面有着广泛用途.一种合成阿魏酸的反应可表示为下列说法正确的是( )


| A、可用KMnO4酸性溶液检测上述反应是否有阿魏酸生成 |
| B、香兰素、阿魏酸均可与Na2CO3、NaOH溶液反应 |
| C、通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 |
| D、与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有3种 |
下列化学反应中,硝酸只表现氧化性的是( )
| A、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
| B、CuO+2HNO3 (稀)=Cu(NO3)2+H2O |
| C、C+4HNO3 (浓)=CO2↑+4NO2↑+2H2O |
| D、3Ag+4HNO3 (稀)=3 AgNO3+NO↑+2H2O |
能正确表示下列反应的离子方程式的是( )
| A、向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | ||||
| B、铜片与浓HNO3:Cu+NO3-+4H+═Cu2++NO↑+2H2O | ||||
C、氯化铵溶液与浓NaOH溶液混合后加热:NH4++OH-
| ||||
D、碳酸氢铵溶液与足量的NaOH溶液混合后加热NH4++OH-
|
下列说法正确的是( )
| A、SiCl4、PCl5分子中各原子最外层均达到8电子稳定结构 |
B、右表中的数字代表的是元素的原子序数.表中数字所对应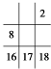 的元素与它们在周期表中的位置是相符的 的元素与它们在周期表中的位置是相符的 |
| C、元素的化学性质主要决定于核外电子数 |
| D、元素周期表中金属和非金属元素分界线附近的元素没有用于制造半导体材料的 |


 +R3CHO,根据已有知识并结合相关信息,写出以
+R3CHO,根据已有知识并结合相关信息,写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: