题目内容
11.在密闭容器中盛有H2、O2、Cl2的混合气体,用电火花使三种气体恰好完全反应,冷至室温得液态产物,溶质的质量分数为25.3%,则容器内原有H2、O2、Cl2的体积比为( )| A. | 6:3:1 | B. | 9:6:1 | C. | 13:6:1 | D. | 26:192:71 |
分析 发生反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl、2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,恰好完全反应,设生成HCl的物质的量为n1,生成H2O的物质的量为n2,根据质量分数列方程确定n1、n2的关系,根据方程式可知n(H2)=$\frac{1}{2}$n(HCl)+n(H2O),n(O2)=$\frac{1}{2}$n(H2O),n(Cl2)=$\frac{1}{2}$n(HCl),在相同状况下,气体的物质的量之比等于其体积比,据此解答.
解答 解:发生反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl、2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,
恰好完全反应,设生成HCl的物质的量为n1,生成H2O的物质的量为n2,则:
$\frac{36.5{n}_{1}}{36.5{n}_{1}+18{n}_{2}}$×100%=25.3%
整理得,n1:n2=1:6,
设n1=1mol,n2=6mol,根据方程式可知n(H2)=$\frac{1}{2}$n(HCl)+n(H2O)=0.5mol+6mol=6.5mol,n(O2)=$\frac{1}{2}$n(H2O)=3mol,n(Cl2)=$\frac{1}{2}$n(HCl)=0.5mol,
则n(H2):n(O2):n(Cl2)=6.5mol:3mol:0.5mol=13:6:1,
在相同状况下,气体的物质的量之比等于其体积比,所以V(H2):V(O2):V(Cl2)=13:6:1,
故选C.
点评 本题考查混合物的有关计算,根据质量分数确定氯化氢与水的物质的量关系是关键,难度中等,注意利用赋值法简化计算,试题培养了学生的化学计算能力.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案| A. | 溴苯中的溴(碘化钾溶液) | B. | 乙烷中的乙烯(氢气) | ||
| C. | 乙酸乙酯中的乙酸(饱和碳酸钠溶液) | D. | 苯中的甲苯(溴水) |
①热稳定性:H2O>HF>H2S ②离子半径:F->Na+>Mg2+>Al3+
③酸性:H3PO4>H2SO4>HClO4④结合质子能力:OH->CH3COO->Cl-( )
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
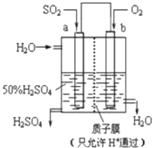
| A. | a为正极,b为负极 | |
| B. | 生产过程中H+向a电极区域运动 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:2H2+SO2-2e-=SO42-+4H+ |
| A. | 放电时OH-向负极移动 | |
| B. | Ag2O2在反应中既是氧化剂又是还原剂 | |
| C. | 每生成1mol Ag外电路转移2 mol电子 | |
| D. | 负极反应为:Zn+4OH--2e-═Zn(OH)42- |
| A. | 碱性氧化物一定是金属氧化物 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 酸分子中有几个H原子即为几元酸 | |
| D. | 盐电离时,只生成一种阳离子,一种阴离子 |