题目内容
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4?7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质.实验步骤如下:

(1)实验中用已经准确量取的浓硫酸配制500mL 1mol?L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要 .
(2)步骤②加入过量氯水后发生反应的离子方程式为 .
(3)步骤④中一系列操作步骤为 、洗涤、灼烧、冷却、称量.
(4)若实验无损耗,则该补血剂含铁元素的质量分数为 .
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1mol?L-1的硫酸溶液,过滤.取滤液加 溶液,溶液变红说明该补血剂已部分变质.向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有 性(填“氧化”或“还原”)的物质.
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是 .
A.KSCN溶液 B.酸性KMnO4溶液 C.铁粉 D.FeCl3溶液.

(1)实验中用已经准确量取的浓硫酸配制500mL 1mol?L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要
(2)步骤②加入过量氯水后发生反应的离子方程式为
(3)步骤④中一系列操作步骤为
(4)若实验无损耗,则该补血剂含铁元素的质量分数为
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1mol?L-1的硫酸溶液,过滤.取滤液加
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是
A.KSCN溶液 B.酸性KMnO4溶液 C.铁粉 D.FeCl3溶液.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)依据溶液配制的标准和过程分析所需仪器;
(2)过量氯水氧化亚铁离子为铁离子;
(3)得到红褐色沉淀过滤,洗涤,灼烧,冷却,称量;
(4)依据铁元素守恒分析计算;
(5)依据铁离子遇到硫氰酸钾溶液形成血红色溶液判断铁离子的存在,加入橙汁,溶液红色褪去,说明橙汁具有还原性,还原铁离子为亚铁离子;
(6)部分补血剂药片表面发黄,取样品研细,溶于1mol?L-1的硫酸溶液,过滤.取滤液检验滤液中是否有Fe2+应选用的试剂是氧化性且具有明显现象的试剂,因为滤液中含有铁离子和亚铁离子,A、KSCN溶液加入不能检验亚铁离子存在;B、酸性KMnO4溶液加入和亚铁离子反应褪色可以证明亚铁离子的存在;C、铁粉加入含有铁离子生成亚铁离子不能证明亚铁离子的存在;D、FeCl3溶液不能检验亚铁离子的存在.
(2)过量氯水氧化亚铁离子为铁离子;
(3)得到红褐色沉淀过滤,洗涤,灼烧,冷却,称量;
(4)依据铁元素守恒分析计算;
(5)依据铁离子遇到硫氰酸钾溶液形成血红色溶液判断铁离子的存在,加入橙汁,溶液红色褪去,说明橙汁具有还原性,还原铁离子为亚铁离子;
(6)部分补血剂药片表面发黄,取样品研细,溶于1mol?L-1的硫酸溶液,过滤.取滤液检验滤液中是否有Fe2+应选用的试剂是氧化性且具有明显现象的试剂,因为滤液中含有铁离子和亚铁离子,A、KSCN溶液加入不能检验亚铁离子存在;B、酸性KMnO4溶液加入和亚铁离子反应褪色可以证明亚铁离子的存在;C、铁粉加入含有铁离子生成亚铁离子不能证明亚铁离子的存在;D、FeCl3溶液不能检验亚铁离子的存在.
解答:
解:(1)溶液配制时用到的仪器除烧杯、500mL容量瓶外,还需要加快溶解,引流作用的玻璃棒,最后定容滴加水到刻度的胶头滴管,
故答案为:玻璃棒、胶头滴管;
(2)步骤②加入过量氯水后发生反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)步骤④是得到氢氧化铁沉淀的存在过程,其中一系列操作步骤为过滤、洗涤、灼烧、冷却、称量,
故答案为:过滤;
(4)依据流程分析可知最后得到氧化铁质量为ng,依据铁元素守恒得到铁的质量分数=
×100%=
%,
故答案为:
%;
(5)部分补血剂药片表面发黄,取样品研细,溶于1mol?L-1的硫酸溶液,过滤.取滤液加KSCN溶液,溶液变红说明该补血剂已部分变质.向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有还原性,
故答案为:KSCN;还原;
(6)部分补血剂药片表面发黄,取样品研细,溶于1mol?L-1的硫酸溶液,过滤.取滤液检验滤液中是否有Fe2+应选用的试剂是氧化性且具有明显现象的试剂,因为滤液中含有铁离子和亚铁离子;
A、KSCN溶液加入不能检验亚铁离子存在,故A不符合;
B、酸性KMnO4溶液加入和亚铁离子反应褪色可以证明亚铁离子的存在,故B符合;
C、铁粉加入含有铁离子生成亚铁离子不能证明亚铁离子的存在,故C不符合;
D、FeCl3溶液不能检验亚铁离子的存在,故D不符合;
故答案为:B.
故答案为:玻璃棒、胶头滴管;
(2)步骤②加入过量氯水后发生反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)步骤④是得到氢氧化铁沉淀的存在过程,其中一系列操作步骤为过滤、洗涤、灼烧、冷却、称量,
故答案为:过滤;
(4)依据流程分析可知最后得到氧化铁质量为ng,依据铁元素守恒得到铁的质量分数=
| ||
| mg |
| 70n |
| m |
故答案为:
| 70n |
| m |
(5)部分补血剂药片表面发黄,取样品研细,溶于1mol?L-1的硫酸溶液,过滤.取滤液加KSCN溶液,溶液变红说明该补血剂已部分变质.向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有还原性,
故答案为:KSCN;还原;
(6)部分补血剂药片表面发黄,取样品研细,溶于1mol?L-1的硫酸溶液,过滤.取滤液检验滤液中是否有Fe2+应选用的试剂是氧化性且具有明显现象的试剂,因为滤液中含有铁离子和亚铁离子;
A、KSCN溶液加入不能检验亚铁离子存在,故A不符合;
B、酸性KMnO4溶液加入和亚铁离子反应褪色可以证明亚铁离子的存在,故B符合;
C、铁粉加入含有铁离子生成亚铁离子不能证明亚铁离子的存在,故C不符合;
D、FeCl3溶液不能检验亚铁离子的存在,故D不符合;
故答案为:B.
点评:本题考查了物质性质实验探究实验的过程分析判断,铁及其化合物性质的掌握是解题关键,题目难度中等.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A、A电极是负极 |
| B、外电路中电子由B电极通过导线流向A电极 |
| C、产物为无污染的水,属于环境友好电池 |
| D、该电池的总反应:2H2+O2═2H2O |
在化学反应3CO+Fe2O3
2Fe+3CO2中,氧化剂为( )
| ||
| A、Fe2O3 |
| B、Fe |
| C、CO |
| D、CO2 |
下列说法正确的是( )
| A、乙酸的分子式:C2H4O |
| B、甲烷的分子式:CH4 |
| C、乙酸的结构简式:CH3CH2OH |
| D、乙烷的结构简式:C2H6 |
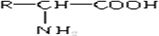 ,其分子中一定含有羧基(-COOH)和
,其分子中一定含有羧基(-COOH)和 是一种重要的合成材料,契单体的结构简式为
是一种重要的合成材料,契单体的结构简式为
 )由两分子某链状有机物A反应得到,则与链状有机物A互为同分异构体且含有相同官能团的结构简式为
)由两分子某链状有机物A反应得到,则与链状有机物A互为同分异构体且含有相同官能团的结构简式为