题目内容
硫酸亚铁铵的化学式为(NH4)2SO4·FeSO4·6H2O,商品名为莫尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了。三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4??FeSO4??6H2O | 17.2 | 26.4 | 33.0 | 46.0 | — | — |
实验室制取少量莫尔盐的流程如下:

试回答下列问题:
(1)步骤1中加入10%Na2CO3溶液的主要作用是除去铁屑表面的油污,简述其除去油污的原理
(2)将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机
(3)步骤4中析出的晶体不含(NH4)2SO4和FeSO4的原因是 ,理论上制得的莫尔盐的质量为 。
(二)称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液。用未知浓度的KMnO4酸性溶液进行滴定。
(1)滴定时,将KMnO4酸性溶液装在_______(填“酸式”或“碱式”)滴定管。试写出该滴定过程中的离子方程式:___ __;
(2)判断该反应到达滴定终点的现象为 ;
(3)假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为 mol/L
(一)(1)热的Na2CO3会发生水解反应使溶液碱性,在碱性条件下使油脂充分水解而除去(2) 浓缩至液体表面出现洁净薄膜(3) 在相同温度下,(NH4)2SO4·FeSO4·6H2O的溶解度比(NH4)2SO4、FeSO4小;7(m1—m2)g
(二).(1)酸式 5Fe2+ + MnO4- + 8H+= 5Fe3++ Mn2+ + 4H2O(2)当最后一滴KMnO4酸性溶液滴下时,溶液变成紫色,30s内不褪色,说明达到滴定终点(3)1/V
解析:
本题考查莫尔盐的制备。(一)(1)Na2CO3会发生水解反应使溶液碱性,碱性条件下酯类物质发生水解反应;(2)蒸发时不能将水蒸干,因为Fe2+容易被氧化;(3)通过比较表格中数据发现,在相同温度下,(NH4)2SO4·FeSO4·6H2O的溶解度比(NH4)2SO4、FeSO4小,所以析出的是(NH4)2SO4·FeSO4·6H2O,参加反应铁的质量为(m1—m2)g,根据铁元素的守恒:Fe~(NH4)2SO4·FeSO4·6H2O,求出莫尔盐的质量为:7(m1—m2)g;(二)(1)KMnO4酸性溶液具有强氧化性,能够氧化橡胶管,应该用酸式滴定管盛装;(2)Fe2+被氧化为Fe3+,MnO4-被还原成Mn2+,则滴定终点时,紫色变为无色,若30s内不褪色,说明达到滴定终点;(3)依据关系式:5Fe2+~MnO4-,1.96g的该硫酸亚铁铵的物质的量为0.005mol,则n(Fe2+)=0.005mol,所以求出n(MnO4-)=0.001mol,c(MnO4-)=1/V mol/L。

| 温度/℃ 溶解度/g 盐 |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| FeSO4?7H2O | 15.7 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)SO4FeSO4?6H2O | 12.5 | 17.2 | 21.6 | 28.1 | 33.0 | 40.0 | - |
【实验原理】
【实验用品】
10%Na2CO3溶液、Fe屑、3mol/LH2SO4、(NH4)2SO4固体、蒸馏水、无水乙醇.锥形瓶、蒸发皿、酒精灯、玻璃棒、烧杯、铁架台、漏斗、托盘天平、量筒、滤纸.
【实验步骤】
(1)Fe屑的处理和称量
称取3g铁屑,放入锥形瓶,用l0%Na2CO3溶液,除去Fe屑表面的油污,将剩余的碱液倒掉,用蒸馏水把Fe冲洗干净,干燥后称其质量m1g.
(2)FeSO4的制备
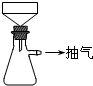
将称量好的Fe屑放人锥形瓶中,加入l5mL 3mol/LH2SO4,加热10min后(有氢气生成,用明火加热注意安全).
①a处的操作是
②制取FeSO4时,加入的Fe为什么要过量?(用离子方程式表示)
(3)(NH4)2SO4?FeSO4?6H2O的制备
根据FeSO4的物质的量,计算并称取(NH4)2SO4固体,并将其加入上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止.
①b处的操作是
(4)产品检验
微量Fe3+的分析.称0.5g产品置于25mL比色管中,加水溶解后加1mL 25%的KSCN溶液,继续加水至25mL刻度,摇匀,与教师所给标准对比,评价产品质量.写出该过程所发生反应的离子方程式:
【实验记录】
| 起始铁的质量m1/g | 反应后铁的质量m2/g | 莫尔盐的质量 | 产率 | |
| 理论产量/g | 实际产量m3/g | |||
| 5.0 | 2.2 | c | 14.7 | d |

 【实验化学】
【实验化学】