题目内容
15.已知常温下 0.1mol/LCH3COOH 溶液中 c(H+)=1.32×10-3 mol/L,则该CH3COOH 溶液中 水的离子积常数KW是( )| A. | 1×10-14 | B. | 1×10-13 | C. | 1.32×10-14 | D. | 1.32×10-15 |
分析 常温下水溶液中氢离子浓度和氢氧根离子浓度乘积为常数,为离子积常数,酸溶液中氢离子浓度大于氢氧根离子浓度;
解答 解:常温下水溶液中氢离子浓度和氢氧根离子浓度乘积为常数,离子积常数Kw=10-14,适用于稀酸、稀碱和盐溶液,
故选A.
点评 本题考查了离子积常数的应用条件,离子积常数随温度变化,掌握基础是关键,题目较简单.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
5.由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH $\stackrel{高温}{→}$3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2→2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
完成下列填空:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和cd.(填序号)
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.泥三角
(2)在“加酸岐化”时不宜用硫酸的原因是生成K2SO4溶解度小,会降低产品的纯度;不宜用盐酸的原因是盐酸具有还原性,会被氧化,降低产品的量.
反应之后得到高锰酸钾的步骤是:过滤、蒸发结晶、趁热过滤.
该步骤能够得到高锰酸钾的原理是KMnO4和K2CO3的溶解度不同.
(3)采用电解法也可实现K2MnO4的转化,2K2MnO4+2H2O$\stackrel{通电}{→}$ 2KMnO4+2KOH+H2↑.与原方法相比,电解法的优势为 K2MnO4中的锰元素可以完全转化到KMnO4中,原子利用率高.
熔融氧化 3MnO2+KClO3+6KOH $\stackrel{高温}{→}$3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2→2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
| 物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和cd.(填序号)
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.泥三角
(2)在“加酸岐化”时不宜用硫酸的原因是生成K2SO4溶解度小,会降低产品的纯度;不宜用盐酸的原因是盐酸具有还原性,会被氧化,降低产品的量.
反应之后得到高锰酸钾的步骤是:过滤、蒸发结晶、趁热过滤.
该步骤能够得到高锰酸钾的原理是KMnO4和K2CO3的溶解度不同.
(3)采用电解法也可实现K2MnO4的转化,2K2MnO4+2H2O$\stackrel{通电}{→}$ 2KMnO4+2KOH+H2↑.与原方法相比,电解法的优势为 K2MnO4中的锰元素可以完全转化到KMnO4中,原子利用率高.
6.下列试剂的保存方法错误的是( )
| A. | 少量的钠保存在煤油中 | B. | 漂白粉密封保存 | ||
| C. | 新制的氯水保存在棕色玻璃瓶中 | D. | 少量的钠保存在四氯化碳中 |
3.日本大地震造成了福岛第一核电站核放射性物质${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs向外界泄漏.下列相关说法错误的是( )
| A. | CsOH的碱性比KOH强 | B. | ${\;}_{55}^{137}$Cs中有82个中子 | ||
| C. | HI比HF还原性强 | D. | KIO3是碘的最高价含氧酸盐 |
10.某温度下,中水D2O的离子积常数为1.6×10-15,若用pH一样的定义来规定pD=-lgc(D+),以下关于pD的叙述不正确的是( )
| A. | 该温度下,中性溶液的pD≠7.0. | |
| B. | 含0.01mol的NaOD的D2O溶液1L,其pD=12.0. | |
| C. | 溶解0.01mol的DCl的D2O溶液1L,其pD=2.0. | |
| D. | 在100mL0.25mol/L的DCl重水溶液中,加入50mL0.2mol/L的NaOD的重水溶液,其pD=1.0 |
20.下列属于电解质的是( )
| A. | 酒精 | B. | CO2 | C. | 盐酸 | D. | NaOH |
7.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 | |
| B. | 1 mol氯气与足量的氢氧化钠溶液反应电子转移总数为2NA | |
| C. | 500 mL1 mol•L-1 MgCl2溶液中含有Cl-数目为0.5NA | |
| D. | 标况下11.2 L H2O与4.0gCH4所含氢原子个数均为NA |
6.下列有关说法中正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 水中的溶解度:Na2CO3<NaHCO3 | ||
| C. | 铜与硫磺反应生成硫化铜 | D. | 氨气与氯化氢气体反应生成白雾 |
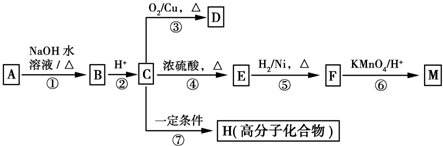
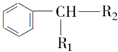 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$ 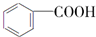 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)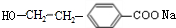 .
.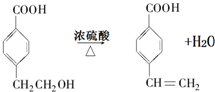 .
. .
.