题目内容
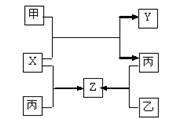
水煤气(主要成分:CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C(s)+H2O(g)![]() CO(g)+H2(g);ΔH=+131.3 kJ·mol-1
CO(g)+H2(g);ΔH=+131.3 kJ·mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.
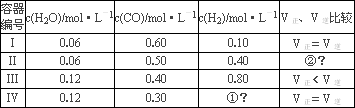
请根据上表数据计算出该温度下该反应的平衡常数的数值________
填写表中相应的空格①________、②________;
(2)另有一个容积可变的密闭容器.恒温恒压下,向其中加入1.0 mol炭和1.0 mol水蒸气,发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍,平衡时水蒸气的转化率为________;向该容器中补充a mol炭,水蒸气的转化率将________(填“增大”、“减小”、“不变”).
(3)己知:CO(g)+![]() O2(g)=CO2(g);ΔH=-283.0 kJ·mo1-1
O2(g)=CO2(g);ΔH=-283.0 kJ·mo1-1
H2(g)+![]() O2(g)=H2O(g);ΔH=-241.8 kJ·mo1-1
O2(g)=H2O(g);ΔH=-241.8 kJ·mo1-1
C(s)+![]() O2(g)=CO(g);ΔH=-110.5 kJ·mo1-1
O2(g)=CO(g);ΔH=-110.5 kJ·mo1-1
那么,将12 g炭完全转化为水煤气,然后再燃烧,整个过程放出________kJ的热量.
答案:
解析:
解析:
(1)1 mol·L-1(3分)
①0.40 (2分)
②V正<V逆 (2分);
(2)25%(2分) 不变(2分)
(3)393.5(3分)

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目