��Ŀ����
��ѧ������ѧϰ��ѧ����Ҫ���ߣ����л�ѧ�����У���ȷ����
A����֪��2H2(g)��O2(g) �� 2H2O(g)����H����483.6 kJ/mol��������ȼ����Ϊ241.8 kJ/mol
B����AgCl����Һ�м���KI��Һ�����Ag+ + I- = AgI��
C��ij��Ӧ�SH��0,��S>0,��÷�Ӧ�����������¾����Է����С�
D����ϡHNO3�ܽ�FeS���壺FeS+2H+=Fe2++H2S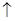
���𰸡�
C
��������
���������ȼ��������һ�������£�1mol��ȼ����ȫȼ�������ȶ���������ʱ���ų���������A����ȷ����Ϊˮ���ȶ�״̬��Һ̬��B����ȷ��Ӧ����AgCl+ I-��Cl����AgI�������ݡ�G����H��T����S��֪��ֻҪ��GС��0����Ӧ�����Է��ģ�����ѡ��C��ȷ���������������ᣬ��FeS��Ӧ��������������ԭ��Ӧ��D����ȷ����ѡC��
���㣺���鳣����ѧ����������ж�
���㣺�����Ļ�ѧ������Ҫ����Ԫ�ط��š���ѧʽ�����ϼۡ�����ʽ��ԭ�ӽṹʾ��ͼ���ṹʽ���ṹ��ʽ�Լ�����ʽ����ģ�͵ȣ���Ҫ������ס��

��ϰ��ϵ�д�
 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
�����Ŀ
��ѧ������ѧϰ��ѧ����Ҫ���ߣ����л�ѧ������ȷ���ǣ�������
A�� ��ʾ14Cԭ�ӽṹʾ��ͼ ��ʾ14Cԭ�ӽṹʾ��ͼ | B�� ��ʾCCl4���ӵı���ģ�� ��ʾCCl4���ӵı���ģ�� | C��HClO�Ľṹʽ��H-Cl-O | D�� ��ʾ1��1��2��2-�������� ��ʾ1��1��2��2-�������� |