题目内容
工业上利用电解污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下如图1:
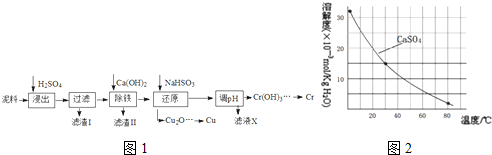
已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2如下:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有 .
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围为: ~ ;
②将浊液加热到80℃, .
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 .

已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2如下:
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围为:
②将浊液加热到80℃,
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式
考点:金属的回收与环境、资源保护,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,在污泥中加入硫酸酸浸,过滤,在滤液中加入熟石灰调节溶液PH沉淀铁离子,加入亚硫酸氢钠还原得到氧化亚铜,用来制备铜,加入氢氧化钙调节溶液PH得到氢氧化铬,得到金属铬;
(1)根据氧化铜和硫酸反应生成硫酸铜和水进行解答;
(2)根据图表可知铁离子完全沉淀pH为3.2以及温度越高;
(3)亚硫酸氢根离子具有强的还原性,能和铜离子之间发生反应生成硫酸根离子以及氧化亚铜;
(1)根据氧化铜和硫酸反应生成硫酸铜和水进行解答;
(2)根据图表可知铁离子完全沉淀pH为3.2以及温度越高;
(3)亚硫酸氢根离子具有强的还原性,能和铜离子之间发生反应生成硫酸根离子以及氧化亚铜;
解答:
解:污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,在污泥中加入硫酸酸浸,过滤,在滤液中加入熟石灰调节溶液PH沉淀铁离子,加入亚硫酸氢钠还原得到氧化亚铜,用来制备铜,加入氢氧化钙调节溶液PH得到氢氧化铬,得到金属铬;
(1)氧化铜和硫酸反应生成硫酸铜和水,所以在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有硫酸铜;
故答案为:CuSO4;
(2)根据图表可知铁离子完全沉淀pH为3.2,所以在除铁操作中,需要除去Fe3+和CaSO4,相关操作:①加入石灰乳调节pH到3.2~4.3;②将浊液加热到80℃,趁热过滤;
故答案为:3.2~4.3;趁热过滤;
(3)硫酸氢根离子具有强的还原性,能和铜离子之间发生反应生成硫酸根离子以及氧化亚铜,发生的反应为:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+
,在酸性环境下,亚硫酸氢根离子和氢离子之间反应生成的二氧化硫具有毒性,能污染空气,
故答案为:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+;产生SO2污染环境;
(1)氧化铜和硫酸反应生成硫酸铜和水,所以在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有硫酸铜;
故答案为:CuSO4;
(2)根据图表可知铁离子完全沉淀pH为3.2,所以在除铁操作中,需要除去Fe3+和CaSO4,相关操作:①加入石灰乳调节pH到3.2~4.3;②将浊液加热到80℃,趁热过滤;
故答案为:3.2~4.3;趁热过滤;
(3)硫酸氢根离子具有强的还原性,能和铜离子之间发生反应生成硫酸根离子以及氧化亚铜,发生的反应为:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+
,在酸性环境下,亚硫酸氢根离子和氢离子之间反应生成的二氧化硫具有毒性,能污染空气,
故答案为:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+;产生SO2污染环境;
点评:本题考查了离子方程式的书写、物质的分离等知识点,难度不大,注意会运用溶液的pH值对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下列各组溶液,只要用试管和胶头滴管,不用任何化学试剂就可以鉴别的一组是( )
| A、KOH和Al2(SO4)3 |
| B、H2SO4和Na2CO3 |
| C、CaCl2和Na2CO3 |
| D、Ba(OH)2和NaHSO4 |
下列物质属于羧酸的是( )
| A、HCHO |
| B、CH3COOH |
| C、CH3CH2OH |
| D、CH3COOC2H5 |
下列有关说法正确的是( )
| A、因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B、常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 |
| C、在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 |
| D、加热0.1mol?L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强 |
有机化合物的结构可用键线式表示,如CH2=CHCH2Br可表示为 .则有机物
.则有机物 的二氯代物有( )
的二氯代物有( )
 .则有机物
.则有机物 的二氯代物有( )
的二氯代物有( )| A、2种 | B、4种 | C、5种 | D、6种 |
在电解水制取H2和O2时,为增强溶液的导电性,加入一些电解质.下列物质中最合适的是( )
| A、AgNO3 |
| B、H2O |
| C、NaCl |
| D、Na2SO4 |

 元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.
元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.
