题目内容
(1)取一支试管,加入15 mL蒸馏水,再加入5 mL己烷,静置,取黄豆大的金属钠(ρ=?0.97 g·cm-3),轻轻放入这只装有水和己烷的试管中。试推测能观察到的实验现象是_______________。(2)取另一支试管,加入15 mL蒸馏水和5 mL己烷,静置,取黄豆大的金属钾(ρ=0.86 g·cm-3)轻轻放入其中。
如(1)和(2)两个实验中金属钠和金属钾都是同时投入液体中,试推测哪种金属先消耗完?分析原因。
(1)钠块表面落在己烷和蒸馏水的界面上,与水接触时钠表面会有气泡产生。气泡积累到一定量时会产生较大的浮力使钠块上升,当附着在钠块表面的氢气逸出后,钠块又下沉到水和己烷的界面上,又发生反应,重复发生上述现象直到钠耗尽
(2)我们知道,若把同样大小的钠、钾分别放入水中,由于钾比钠活泼,钾跟水反应的现象明显比钠剧烈,钾消耗完的时间比钠要短。但在该题实验中,由于钾、钠的密度大小不同,在浮力的影响下,就会产生出人意料的现象。钾的密度比钠的密度小,因此钾在己烷中上浮只需较小的浮力,较少量的气泡就可使钾上浮,所以钾与水接触的时间会更短,上下运动时间会更长,反应消耗完的时间也就更长。
解析:实验现象包括反应前的现象、反应中的现象和反应后的现象。钠的密度小于水而大于己烷,所以起初应位于两种液体的界面上。当反应进行后,由于放出气体,从而使得钠粒所受液体的浮力增大,此时钠由二液体的界面进入己烷层。当气体逸出后,钠块所受的重力又大于浮力,于是又回落到界面上,再与水反应,再进入己烷层,如此反复进行,直到钠块消耗完。
若用钠块和钾块做对比实验,由于二者的体积近似相等,但二者的密度不同,所以钾块比钠块轻。这样钾块比钠块生成的气体还少时,就受浮力影响而进入己烷层,从而暂时停止与水的反应,这样钾比钠跳跃得更加频繁,虽比钠与水的反应要快,但每次与水接触的时间短,所以反应所用的时间反而长。

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
某同学创新设计制备氢氧化亚铁的实验方案:
(一)查阅资料
资料1:乙醇不与氢氧化钠或硫酸亚铁反应;乙醇与水互溶,氢氧化钠能溶于乙醇;硫酸亚铁在乙醇中的溶解度比在水中的溶解度小.氮气不能与铜反应.
资料2:几种含铁物质的颜色
(二)实验步骤及现象
①取少量的新制硫酸亚铁晶体于大试管中,向其中加入5mL热蒸馏水,使之充分溶解,然后向其中慢慢加入10mL无水乙醇,这时会发现溶液中有小气泡逸出,静置,直到无小气泡冒出为止.
②另取一支试管,向其中加入半药匙固体氢氧化钠,然后向其中加入5mL无水乙醇,充分溶解后静置.
③用长胶头滴管吸取新配制的氢氧化钠的乙醇溶液,伸入硫酸亚铁溶液中,慢慢地挤压橡胶头,连续吸取几次,使之充分反应,静置片刻,这时在试管底会有大量的白色凝乳状溶胶沉降.
④小心地倒去上层溶液,再向试管中加入3mL无水乙醇洗涤,连续洗涤两三次,这时白色的凝乳状溶胶会变成白色固体,然后倒在滤纸上使乙醇充分挥发,便得到白色固体粉末.
(1)为避免硫酸亚铁在溶于水的过程中被氧化,通常可以向溶液中加入 .向硫酸亚铁溶液中慢慢加入无水乙醇时,产生气泡的原因是 .某同学制备无水乙醇的方法是向无水乙醇(含乙醇的质量分数为99.5%以上)中加入一定量的氯化钙,然后蒸馏得到无水乙醇,你认为此方法能否得到无水乙醇? (填“能”或“否”).
(2)预测上述白色固体的成分可能是 ,保持白色的主要原因是 .
(3)写出生成白色沉淀的化学方程式: .
(三)探究产物成分
Ⅰ利用如图所示装置检验白色粉末的性质:
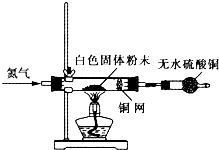
先通入氮气排尽装置内的空气后,继续通入氮气,然后加热硬质试管,观察到无水硫酸铜逐渐变成蓝色;硬质试管里的白色固体粉末逐渐变成黑色;铜网没有明显的颜色变化.当白色固体粉末全部变成黑色粉末时,停止加热,继续通入氮气至硬质试管冷却.
Ⅱ.待冷却后,取适量黑色粉末溶于少量的稀盐酸中,黑色粉末溶解,溶液呈浅绿色,不产生气泡.
Ⅲ.取Ⅱ中的溶液于试管中,滴加酸性高锰酸钾溶液,溶液的紫色褪去.
(4)实验1中,氮气的作用是 ,铜网的作用是 .
(5)证明白色固体粉末中含有+2价铁的实验现象为 :写出符合要求的方程式: .
属于分解反应的化学方程式: ;属于氧化还原反应的离子方程式:
(6)某同学在上述实验的基础上,增加了一个实验确认白色固体中不含+3价铁,设计的实验可能是 .
(一)查阅资料
资料1:乙醇不与氢氧化钠或硫酸亚铁反应;乙醇与水互溶,氢氧化钠能溶于乙醇;硫酸亚铁在乙醇中的溶解度比在水中的溶解度小.氮气不能与铜反应.
资料2:几种含铁物质的颜色
| 化学式 | Fe | FeO | Fe2O3 | Fe3O4 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | 银白色 | 黑色 | 红色 | 黑色 | 白色 | 红褐色 |
①取少量的新制硫酸亚铁晶体于大试管中,向其中加入5mL热蒸馏水,使之充分溶解,然后向其中慢慢加入10mL无水乙醇,这时会发现溶液中有小气泡逸出,静置,直到无小气泡冒出为止.
②另取一支试管,向其中加入半药匙固体氢氧化钠,然后向其中加入5mL无水乙醇,充分溶解后静置.
③用长胶头滴管吸取新配制的氢氧化钠的乙醇溶液,伸入硫酸亚铁溶液中,慢慢地挤压橡胶头,连续吸取几次,使之充分反应,静置片刻,这时在试管底会有大量的白色凝乳状溶胶沉降.
④小心地倒去上层溶液,再向试管中加入3mL无水乙醇洗涤,连续洗涤两三次,这时白色的凝乳状溶胶会变成白色固体,然后倒在滤纸上使乙醇充分挥发,便得到白色固体粉末.
(1)为避免硫酸亚铁在溶于水的过程中被氧化,通常可以向溶液中加入
(2)预测上述白色固体的成分可能是
(3)写出生成白色沉淀的化学方程式:
(三)探究产物成分
Ⅰ利用如图所示装置检验白色粉末的性质:

先通入氮气排尽装置内的空气后,继续通入氮气,然后加热硬质试管,观察到无水硫酸铜逐渐变成蓝色;硬质试管里的白色固体粉末逐渐变成黑色;铜网没有明显的颜色变化.当白色固体粉末全部变成黑色粉末时,停止加热,继续通入氮气至硬质试管冷却.
Ⅱ.待冷却后,取适量黑色粉末溶于少量的稀盐酸中,黑色粉末溶解,溶液呈浅绿色,不产生气泡.
Ⅲ.取Ⅱ中的溶液于试管中,滴加酸性高锰酸钾溶液,溶液的紫色褪去.
(4)实验1中,氮气的作用是
(5)证明白色固体粉末中含有+2价铁的实验现象为
属于分解反应的化学方程式:
(6)某同学在上述实验的基础上,增加了一个实验确认白色固体中不含+3价铁,设计的实验可能是