题目内容
下列配制的溶液浓度偏高的是( )
| A、配制盐酸用量筒量取盐酸时俯视刻度线 |
| B、配制盐酸定容时,仰视容量瓶刻度线 |
| C、称量4 g NaOH配制0.1 mol/L NaOH溶液1000 mL时,砝码错放左盘 |
| D、NaOH溶解后未经冷却即注入容量瓶至刻度线 |
考点:配制一定物质的量浓度的溶液
专题:
分析:根据c=
,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.
| n |
| V |
解答:
解:A、配制盐酸用量筒量取盐酸时俯视刻度线,会导致所量取的弄盐酸的体积偏小,则配制出的溶液的浓度偏低,故A不选;
B、定容时仰视刻度线会导致溶液体积偏大,则浓度偏低,故B不选;
C、砝码错放在左盘,会导致称量的药品的质量偏小,则浓度偏低,故C不选;
D、NaOH在烧杯中溶解后,未冷却就转移到容量瓶中并定容,待溶液冷却后体积偏小,则浓度偏大,故D选;
故选D.
B、定容时仰视刻度线会导致溶液体积偏大,则浓度偏低,故B不选;
C、砝码错放在左盘,会导致称量的药品的质量偏小,则浓度偏低,故C不选;
D、NaOH在烧杯中溶解后,未冷却就转移到容量瓶中并定容,待溶液冷却后体积偏小,则浓度偏大,故D选;
故选D.
点评:本题考查了一定物质的量浓度溶液的配制过程中的误差分析,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B、常温下,pH=3的醋酸溶液,稀释至10倍后pH=4 |
| C、常温下,0.2 mol?L-1的盐酸,与等体积水混合后pH=1 |
| D、常温下,pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
下列实验误差分析错误的是( )
| A、用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| B、用润湿的pH试纸测稀碱溶液的pH,测定值偏小 |
| C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D、测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
下列推断合理的是( )
| A、一定条件下,使用催化剂能加快反应速率并能提高反应物的平衡转化率 |
| B、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| C、甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
下列分离提纯的方法正确的是( )
| A、除去氯化铵中的碘,用升华的方法 |
| B、用酒精提取碘水中的碘 |
| C、分馏法分离乙醇和乙酸 |
| D、用重结晶法除去硝酸钾中的氯化钠 |
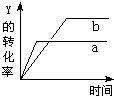 反应 X(气)+Y(气)?2Z(气)+Q(Q>0),在一定条件下,反应物Y的转化率与反应时间(t)的关系如图所示.若使曲线a变为曲线b可采取的措施是( )
反应 X(气)+Y(气)?2Z(气)+Q(Q>0),在一定条件下,反应物Y的转化率与反应时间(t)的关系如图所示.若使曲线a变为曲线b可采取的措施是( )| A、加入催化剂 | B、降低温度 |
| C、增大压强 | D、增大Y的浓度 |