题目内容
镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成。放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究。
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
M(OH)n | Ksp | pH | |
开始沉淀 | 沉淀完全 | ||
Al(OH)3 | 2.0×10-32 | 3.8 | —— |
Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
回答下列问题:
(1)该电池的负极材料是___________________,正极反应式为_________________,
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作__________min(小数点后保留2位)。(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是_____________。过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是_______________和___________________。若将两种杂质阳离子都沉淀析出,pH应控制在___________(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案_____________。
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4·2H2O和滤液A,A的主要成分是_____________;电解滤液A,在阴极产生气体B______(填分子式);在阳极产生气体C______(填分子式)。将NiC2O4·2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为______(填“B”、“C”)极气体,判断依据是_________。
下表是元素周期表的一部分,按要求填空(均填元素符号或化学式):
周期 族 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
4 | ⑩ |
(1)⑧位于元素周期表中第_______周期第_______ 族。
(2)在这些元素中,最活泼的非金属元素是______(填元素符号);元素的最高价氧化物对应水化物中,碱性最强的是______(填化学式)。
(3)④的单质和②的单质在点燃条件下生成物的电子式是_______;⑨的气态氢化物和溴化氢相比,较稳定的是___________(写化学式)。
(4)⑥与⑨形成的化合物和水反应,生成一种弱酸和一种强酸,该反应的化学方程式是_________________。
(5)元素①的气态氢化物与其最高价氧化物的水化物反应的化学方程式_________________。
(6)⑨的单质与⑩的最高价氧化物的水化物反应的离子方程式为___________________


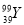 的说法正确的是( )
的说法正确的是( )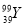 的质子数与中子数之差为50 D.
的质子数与中子数之差为50 D. 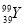 和
和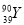 是两种不同的核素
是两种不同的核素
 6H2(g) + 2CO2(g): △H>0
6H2(g) + 2CO2(g): △H>0