题目内容
工业上常用碳在高温下与二氧化硅反应制取粗硅:SiO2+2C Si+2CO↑.在该反应中,作为氧化剂的物质是________(填化学式,下同),作为还原剂的物质是________.若利用该反应制取14g Si,则需消耗________mol SiO2.
Si+2CO↑.在该反应中,作为氧化剂的物质是________(填化学式,下同),作为还原剂的物质是________.若利用该反应制取14g Si,则需消耗________mol SiO2.
SiO2 C 0.5
分析:SiO2+2C Si+2CO↑中,Si元素的化合价由+4价降低为0,C元素的化合价由0升高为+2价,结合氧化还原反应中的基本概念来解答.
Si+2CO↑中,Si元素的化合价由+4价降低为0,C元素的化合价由0升高为+2价,结合氧化还原反应中的基本概念来解答.
解答:SiO2+2C Si+2CO↑中,Si元素的化合价由+4价降低为0,C元素的化合价由0升高为+2价,
Si+2CO↑中,Si元素的化合价由+4价降低为0,C元素的化合价由0升高为+2价,
则SiO2为氧化剂,C为还原剂,
该反应制取14gSi,其物质的量为 =0.5mol,由Si原子守恒可知,消耗0.5molSiO2,
=0.5mol,由Si原子守恒可知,消耗0.5molSiO2,
故答案为:SiO2;C;0.5.
点评:本题考查氧化还原反应,注意反应中元素的化合价变化是解答的关键,并学会利用原子守恒计算,题目难度不大.
分析:SiO2+2C
 Si+2CO↑中,Si元素的化合价由+4价降低为0,C元素的化合价由0升高为+2价,结合氧化还原反应中的基本概念来解答.
Si+2CO↑中,Si元素的化合价由+4价降低为0,C元素的化合价由0升高为+2价,结合氧化还原反应中的基本概念来解答.解答:SiO2+2C
 Si+2CO↑中,Si元素的化合价由+4价降低为0,C元素的化合价由0升高为+2价,
Si+2CO↑中,Si元素的化合价由+4价降低为0,C元素的化合价由0升高为+2价,则SiO2为氧化剂,C为还原剂,
该反应制取14gSi,其物质的量为
 =0.5mol,由Si原子守恒可知,消耗0.5molSiO2,
=0.5mol,由Si原子守恒可知,消耗0.5molSiO2,故答案为:SiO2;C;0.5.
点评:本题考查氧化还原反应,注意反应中元素的化合价变化是解答的关键,并学会利用原子守恒计算,题目难度不大.

练习册系列答案
相关题目
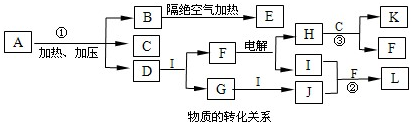

 NH4++NH2-
NH4++NH2- Si+2CO↑.在该反应中,作为氧化剂的物质是 (填化学式,下同),作为还原剂的物质是 .若利用该反应制取14g Si,则需消耗 mol SiO2.
Si+2CO↑.在该反应中,作为氧化剂的物质是 (填化学式,下同),作为还原剂的物质是 .若利用该反应制取14g Si,则需消耗 mol SiO2.