题目内容
科学家一直致力于“人工固氨”的新方法研究。目前合成氨技术原理为:
N2(g) +3H2(g)  2NH3(g)+92.4 kJ/mol
2NH3(g)+92.4 kJ/mol
673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。

(1)下列叙述正确的是( )
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0 L恒容得密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下,N2(g)+3H2(g)  2NH3(g)的平衡常数值为:_____________。
2NH3(g)的平衡常数值为:_____________。
(3)K值越大,表明反应达到平衡时( )。
A. H2的转化率一定越高 B.NH3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨。其实验装置如图。阳极的电极反应为:H2-2e 2H+,则阴极的电极反应为:_____________。
2H+,则阴极的电极反应为:_____________。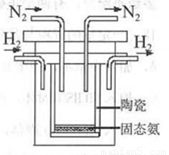
AC(2分)
K =16/15(或1.07或1.1)(2分)
C(2分)
N2+6H+ +6e = 2NH3(2分)
【解析】
试题分析:(1)A、由于a点的氢气浓度大于b点,所以a点正反应速率比b点正反应速率大。B、c点各种物质浓度还在变化,所以还未达到平衡。C、点d和e都表示达到平衡状态,针对同一个反应来说,达到平衡状态后物质的物质的量不再变化,所以氨气的物质的量两个点都相等。D、到达773K时,温度升高,平衡由于是放热反应,所以逆向移动,氨气的物质的量减小。所以比e点的值小。(2)利用三段式来进行计算如下:
N2(g)+3H2(g)  2NH3(g)
2NH3(g)
始 0.8mol 1.6mol 0mol
变 x mol 3xmol 2xmol
终 0.8-x 1.6-3x 2x
达到平衡时,NH3的体积分数为20%,则2x/(0.8-x+1.6-3x+2x)=0.2。解得x=0.2,则平衡时C(N2)=0.3mol/L,C(H2)=0.5mol/L,C(NH3)=0.2mol/L,该条件下的平衡常数
K= =
=  =1.07,故答案为:1.07
=1.07,故答案为:1.07
(3)平衡常数越大,只能表示正向反应程度越大,而转化率和产量还需看投料有多少,也不影响化学反应的速率。选择C。
(4)首先根据题意,此装置是用语合成氨,则阴极的产物应该为氨气,阴极为阳离子得电子的反应,所以反应物为氮气,产物为氨气,根据元素守恒,反应物应还有一个含有氢元素的物质,即为阳极产物氢离子。所以方程式为:N2+6H+ +6e ="=" 2NH3
考点:此题涉及到了平衡图像的分析,化学平衡状态的判断,简单的化学平衡的计算
点评:

 字词句段篇系列答案
字词句段篇系列答案

 。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算
。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算  的平衡常数。
的平衡常数。