题目内容
7.将11.2g铁粉加到250mL 2mol/L的氯化铁溶液中,完全反应后,其结果是( )| A. | 铁有剩余,溶液呈浅绿色,c(Cl-)基本不变 | |
| B. | 往溶液中滴加无色KSCN溶液,不显色 | |
| C. | 溶液中n(Fe2+)与n(Fe3+)之比为6:1 | |
| D. | 氧化产物与还原产物的物质的量之比为2:5 |
分析 铁粉的物质的量为$\frac{11.2g}{56g/mol}$=0.2mol,氯化铁的物质的量为2mol/L×0.25L=0.5mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,根据反应的物质的量之比等于计量数之比知,0.2mol铁粉完全反应需要0.4mol氯化铁,氯化铁有剩余,结合方程式计算解答.
解答 解:铁粉的物质的量为$\frac{11.2g}{56g/mol}$=0.2mol,氯化铁的物质的量为2mol/L×0.25L=0.5mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,假设0.2mol铁粉完全反应,则消耗氯化铁为0.2mol×2=0.4mol<0.5mol,氯化铁有剩余.
A.铁完全反应,氯化铁有剩余,Cl-浓度基本不变,故A错误;
B.氯化铁有剩余,往溶液中滴入无色KSCN溶液,溶液显红色,故B错误;
C.0.2molFe反应生成Fe2+为0.6mol,剩余Fe3+为0.5mol-0.4mol=0.1mol,其物质的量之比为6:1,故C正确;
D.氧化产物与还原产物均为氯化亚铁,Fe被氧化,氯化铁被还原,则氧化产物与还原产物的物质的量之比为1:2,故D错误,
故选C.
点评 本题考查化学方程式有关计算,题目难度中等,关键是根据化学方程式的进行过量计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.某同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A. | 所用NaOH已经潮解 | |
| B. | 定容时观察液面俯视 | |
| C. | 洗涤烧杯和玻棒的溶液未转入容量瓶中 | |
| D. | 用带游砝的托盘天平称2.4 g NaOH时误用了“左码右物”方法 |
18.下列各组物质熔点比较,不正确的是( )
| A. | 金刚石>晶体硅 | B. | NaCl>金刚石 | C. | MgO>l2 | D. | CO2<SiO2 |
15.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1CaCl2溶液等体积混合:c(Na+)+2c(Ca2+)═c(CH3COO-)+c(CH3COOH)+c(Cl-) | |
| B. | 浓度均为0.1mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| C. | pH相同的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)<c(K+)═2c(Ba2+) | |
| D. | 常温下,0.2mol•L-1NH4NO3溶液与0.1mol•L-1NaOH溶液等体积混合,所得pH═9.6的溶液中:c(NO3-)>c(Na+)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) |
2.下列实验可达到实验目的是( )
| A. | 将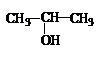 与NaOH的水溶液共热制备CH3-CH═CH2 与NaOH的水溶液共热制备CH3-CH═CH2 | |
| B. | 用甲苯与稀硝酸、稀硫酸的混合酸相混制取TNT | |
| C. | 甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 | |
| D. | 向CH3CH2Br中滴入AgNO3溶液就可以检验溴元素 |
12.下列叙述正确的是( )
| A. | 浓氨水可检验氯气管道漏气 | |
| B. | 将SO2气体通入酸性高锰酸钾溶液中,溶液紫色褪去,证明SO2具有漂白性 | |
| C. | 利用澄清石灰水可以鉴别NaHCO3溶液和Na2CO3溶液 | |
| D. | 向溶液中加入新制氯水,再滴加KSCN溶液,若溶液变红,则证明原溶液中一定含有Fe2+ |
19.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 不需加热就能发生的反应一定是放热反应 | |
| C. | 反应物总能量高于生成物总能量的反应一定是放热反应 | |
| D. | 破坏反应物中的化学键所吸收的总能量多于形成生成物中化学键所放出的总能量的反应一定是放热反应 |
16. 一定条件下,CH4与H2O(g)发生反应CH4(g)+H2O(g)?CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示.下列说法正确的是( )
一定条件下,CH4与H2O(g)发生反应CH4(g)+H2O(g)?CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示.下列说法正确的是( )
 一定条件下,CH4与H2O(g)发生反应CH4(g)+H2O(g)?CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示.下列说法正确的是( )
一定条件下,CH4与H2O(g)发生反应CH4(g)+H2O(g)?CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示.下列说法正确的是( )| A. | 该反应的焓变△H<0 | |
| B. | 图中Z的大小为a<3<b | |
| C. | 图中X点对应的平衡混合物中$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=3 | |
| D. | 温度不变时,图中X点对应的平衡在加压后φ(CH4)减小 |
17.萤火虫体内发光物质是荧光素,其结构简式如下所示,下列有关荧光素的说法不正确的是( )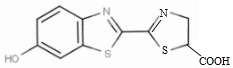

| A. | 荧光素由碳、氢、氧、氮、硫五种元素组成 | |
| B. | 荧光素的化学式是C11H8O3N2S2 | |
| C. | 荧光素属于芳香族化合物 | |
| D. | 荧光素分子中含有羟基、羧基和碳碳双键 |