研究化学反应原理对生产生活很有意义,请用化学反应原理的相关知识回答下列问题:
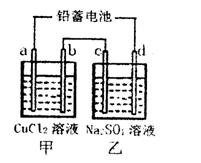
(1)用铅蓄电池电解甲、乙两电解池中的溶液。已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)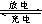 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________
(填写序号)
状况下)
(2)某二元酸H2A在水中的电离方程式是:H2A=H++HA-;HA- H++A2-,请回答下列问题:
H++A2-,请回答下列问题:
①Na2A溶液显_________(填“酸性”、“中性”或“碱性”),理由是________________
(用离子方程式表示)。
②已知0.1mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
(3)二甲醚是一种重要的清洁燃料,利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g); △H=-90.8kJ·mol-1
CH3OH(g); △H=-90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g);△=-41.3kJ·mol-1
CO2(g)+H2(g);△=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式___________________.
(4)SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为:2SO2(g)+O2(g) 2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。

(1)用铅蓄电池电解甲、乙两电解池中的溶液。已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)
 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________(填写序号)
| A.d极为阴极 |
| B.若利用甲池精炼铜,b极应为粗铜 |
| C.放电时铅蓄电池负极的电极反应式为: PbO2(s)+4H+(aq)+ 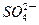 (aq)+4e- (aq)+4e- PbSO4(s)+2H2O(1) PbSO4(s)+2H2O(1) |
| D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36L(标准 |
(2)某二元酸H2A在水中的电离方程式是:H2A=H++HA-;HA-
 H++A2-,请回答下列问题:
H++A2-,请回答下列问题:①Na2A溶液显_________(填“酸性”、“中性”或“碱性”),理由是________________
(用离子方程式表示)。
②已知0.1mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
(3)二甲醚是一种重要的清洁燃料,利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)
 CH3OH(g); △H=-90.8kJ·mol-1
CH3OH(g); △H=-90.8kJ·mol-1②2CH3OH(g)
 CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1③CO(g)+H2O(g)
 CO2(g)+H2(g);△=-41.3kJ·mol-1
CO2(g)+H2(g);△=-41.3kJ·mol-1写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式___________________.
(4)SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为:2SO2(g)+O2(g)
 2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
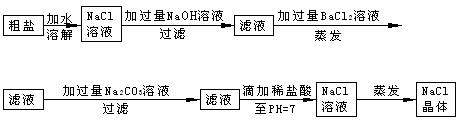
(6分)除去下列物质中的杂质(括号中的物质为杂质),请填表中空白处:
| 物质 | 加入试剂 | 离子方程式 |
| KCl(K2CO3) | .Com] | |
| FeCl3(FeCl2)溶液科 | [网] | |
| FeSO4 (CuSO4) 溶液 | | |
(11·贺州)70等于
0 23386 23394 23400 23404 23410 23412 23416 23422 23424 23430 23436 23440 23442 23446 23452 23454 23460 23464 23466 23470 23472 23476 23478 23480 23481 23482 23484 23485 23486 23488 23490 23494 23496 23500 23502 23506 23512 23514 23520 23524 23526 23530 23536 23542 23544 23550 23554 23556 23562 23566 23572 23580 159627
| A.0 | B.1 | C.7 | D.-7 |
 2KNO2+O2↑
2KNO2+O2↑
 2Fe2O3+8NO2↑+O2↑,现在对KNO3、Cu(NO3)2、Fe(NO3)2 的混合粉末充分加热后未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是 ( )
2Fe2O3+8NO2↑+O2↑,现在对KNO3、Cu(NO3)2、Fe(NO3)2 的混合粉末充分加热后未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是 ( )


 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ; ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1  ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1