某实验小组的同学用碳酸钠粉末、粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究哪两种药品的反应适合在实验室制取CO2.请你参与下列的探究并回答问题.
【提出问题】上述酸和碳酸盐的反应是否适合在实验室制取CO2?
【方案设计】大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2,你认为原因 .
讨论后大家设计了如下三个实验进行对比分析.
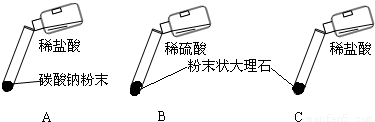
【实验与结论】(1)请你填写实验报告中①、②处的内容.
(2)根据探究结论,实验室制取二氧化碳的反应原理为 (用化学方程式表示).
【拓展与迁移】(1)由上述探究可知,在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等.请你再写出一种需要考虑的因素: .
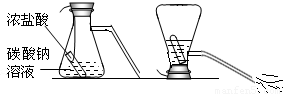
(2)如图是一种灭火器的工作原理示意图,其中用碳酸钠和浓盐酸反应来产生CO2的理由是 .
【提出问题】上述酸和碳酸盐的反应是否适合在实验室制取CO2?
【方案设计】大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2,你认为原因 .
讨论后大家设计了如下三个实验进行对比分析.

【实验与结论】(1)请你填写实验报告中①、②处的内容.
| 实验 | 实验现象 | 实验内容 |
| A | 剧烈反应,迅速放出大量气泡 | 反应速率过快,气体不便收集,不宜于实验室制取二氧化碳 |
| B | 产生气泡,速率迅速减慢,反应几乎停止. | 无法持续产生CO2,不能用于实验室制取CO2 |
| C | ① | ② |
【拓展与迁移】(1)由上述探究可知,在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等.请你再写出一种需要考虑的因素: .
(2)如图是一种灭火器的工作原理示意图,其中用碳酸钠和浓盐酸反应来产生CO2的理由是 .

实验室用98%的浓硫酸配制成稀硫酸,并与锌粒反应制取氢气.
(1)查阅资料.
20℃时不同质量分数硫酸的密度(g/mL)
分析以上数据,可以得出结论(写2条)
①______;
②______;
(2)计算.
配制200g24.5%的稀硫酸,需______g98%浓硫酸和______ g水.实际操作时,取98%浓硫酸______ mL(精确到1mL);
(3)配制稀硫酸.
分别用量筒量取所需水和浓硫酸,先将______倒入烧杯中,然后______;
(4)制取氢气.
①如图中可用于制取、收集氢气的装置是(填字母)______;
②检验氢气纯度的方法如图所示,标明氢气不纯的现象是______.
0 69447 69455 69461 69465 69471 69473 69477 69483 69485 69491 69497 69501 69503 69507 69513 69515 69521 69525 69527 69531 69533 69537 69539 69541 69542 69543 69545 69546 69547 69549 69551 69555 69557 69561 69563 69567 69573 69575 69581 69585 69587 69591 69597 69603 69605 69611 69615 69617 69623 69627 69633 69641 211419
(1)查阅资料.
20℃时不同质量分数硫酸的密度(g/mL)
| 质量 分数 | 0% (纯水) | 1% | 4% | 10% | 16% | 24% | 32% | 36% | 44% | 49% | 60% | 98% |
| 密度 | 1.00 | 1.01 | 1.02 | 1.07 | 1.11 | 1.17 | 1.24 | 1.27 | 1.34 | 1.39 | 1.50 | 1.84 |
①______;
②______;
(2)计算.
配制200g24.5%的稀硫酸,需______g98%浓硫酸和______ g水.实际操作时,取98%浓硫酸______ mL(精确到1mL);
(3)配制稀硫酸.
分别用量筒量取所需水和浓硫酸,先将______倒入烧杯中,然后______;
(4)制取氢气.
①如图中可用于制取、收集氢气的装置是(填字母)______;

②检验氢气纯度的方法如图所示,标明氢气不纯的现象是______.


 Fe+3CO2)(计算结果保留整数)
Fe+3CO2)(计算结果保留整数)