实验室可用KClO3和MnO2的固体混合物加热制取氧气.现取30.5g的固体混合物加热一段时间收集到一定质量的氧气后,停止反应.
(1)欲求得氧气的质量,将试管中的剩余物冷却到室温后,通过向该试管分多次加水测定剩余物质的办法求得.加水的质量与剩余固体的质量见下表:(MnO2不溶于水)
表中m的值为 ,所得氧气的质量为 .
(2)为了测定固体混合物中MnO2的质量分数,需用 方法回收MnO2.
实验结束后,有3位同学分别展示了所测MnO2的质量分数.
老师的评价是:小东结果偏高,小南、小西结果偏低.于是全班同学讨论误差,下列所找原因正确的是(填序号) .
①小东:称量KClO3和MnO2固体混合物时将固体放在天平的右边(1g以下用砝码)
②小东:滤液浑浊就干燥
③小东:烧杯里的物质还未充分溶解就开始过滤
④小南:称余下固体时只在天平的左盘垫了张纸
⑤小西:称余下固体前,部分固体洒落地下
(3)若要证明MnO2是该反应的催化剂,还需补做两个实验:①证明MnO2在反应前后化学性质不变.
②证明MnO2能改变KClO3反应放出氧气的速率.完成②需选用下图装置中的(填序号) .要比较产生O2的快慢,除可以直接观察气泡产生的快慢,还可以 .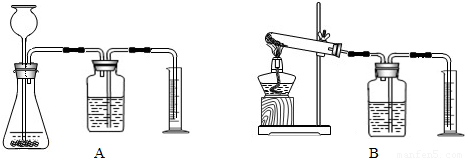
0 66904 66912 66918 66922 66928 66930 66934 66940 66942 66948 66954 66958 66960 66964 66970 66972 66978 66982 66984 66988 66990 66994 66996 66998 66999 67000 67002 67003 67004 67006 67008 67012 67014 67018 67020 67024 67030 67032 67038 67042 67044 67048 67054 67060 67062 67068 67072 67074 67080 67084 67090 67098 211419
(1)欲求得氧气的质量,将试管中的剩余物冷却到室温后,通过向该试管分多次加水测定剩余物质的办法求得.加水的质量与剩余固体的质量见下表:(MnO2不溶于水)
| 编号 | 1 | 2 | 3 | 4 |
| 加水的质量(g) | 20 | 20 | 20 | 20 |
| 剩余固体的质量(g) | 14.5 | 8.1 | m | 6 |
(2)为了测定固体混合物中MnO2的质量分数,需用 方法回收MnO2.
实验结束后,有3位同学分别展示了所测MnO2的质量分数.
| 小东 | 小南 | 小西 | |
| MnO2% | 35% | 10% | 15% |
①小东:称量KClO3和MnO2固体混合物时将固体放在天平的右边(1g以下用砝码)
②小东:滤液浑浊就干燥
③小东:烧杯里的物质还未充分溶解就开始过滤
④小南:称余下固体时只在天平的左盘垫了张纸
⑤小西:称余下固体前,部分固体洒落地下
(3)若要证明MnO2是该反应的催化剂,还需补做两个实验:①证明MnO2在反应前后化学性质不变.
②证明MnO2能改变KClO3反应放出氧气的速率.完成②需选用下图装置中的(填序号) .要比较产生O2的快慢,除可以直接观察气泡产生的快慢,还可以 .








