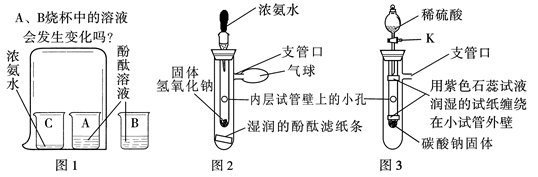
小强在实验室里做实验时,拿出一瓶久置的氢氧化钙粉末,进行如下实验:
(1)取氢氧化钙粉末溶于足量水中,有_______________现象出现,小强判断该药品已变质。
(2)小强进一步做如下实验探究,请你参与并完成下表:
| 实验操作步骤 | 实验现象 | 实验结论 | |
| 取样、加适量的水,搅拌,过滤。 | ①取少量滤渣于试管中,加入_____ | 有气泡产生 | 粉末变质 |
| ②取少量滤液于试管中,滴入______溶液。 | ________________ | 氢氧化钙粉末部分变质。 | |
某化学小组发现一袋包装破损的漂白粉,同学们对其漂白作用是否失效产生了疑问。
【查阅资料】漂白粉的主要成分是Ca(ClO)2、CaCl2和Ca(OH)2,其有效成分是Ca(ClO)2。Ca(ClO)2可溶于水,漂白原理是:它在空气中发生反应Ca(ClO)2+H2O+CO2=CaCO3+2HClO,HClO能使有色物质如品红溶液褪色。HClO不稳定,易分解生成HCl和O2。
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| 把少量漂白粉样品加入水中,通入足量的CO2气体,___________________。 | ______________________。 | 漂白粉的漂白作用已失效。 |
| 实验操作 | 实验现象 | 实验结论 |
| 步骤一:把样品加入水中,充分溶解后过滤, ________________________________。 | 有气泡产生。 | 猜想一成立。 |
| 步骤二:________________________________。 | ______________________。 |
氯气(Cl2)是黄绿色气体,水溶液叫氯水。把品红试纸(染有品红的纸)伸入氯水中,品红褪色。
【发现问题】氯水中的哪些成分能使品红褪色呢?
【查阅资料】氯气溶于水,部分与水反应,方程式为Cl2 + H2O =" HCl" + HClO。其中,HClO的名称叫次氯酸,是一种弱酸,具有强氧化性。
【猜想】猜想1:是氯水中的水使品红褪色的;
猜想2:是氯水中的_______________(填化学式)使品红褪色的;
猜想3:是氯水中的盐酸使品红褪色的;
猜想1:是氯水中的次氯酸使品红褪色的。
【实验探究】
| 实验操作 | 实验现象 | 过程分析 |
| ①把品红试纸伸入水中 | 没有褪色 | 猜想1不成立 |
| ②把品红试纸伸入干燥的氯气中 | 没有褪色 | 猜想2不成立 |
| ③ | 没有褪色 | 猜想3不成立 |
【反思】(1)HClO中氯元素的化合价为_____价。
(2)氯水中加入AgNO3溶液有白色沉淀生成,化学方程式为____________________。
(3)向氯水中滴加紫色石蕊试液,观察到的现象是____________________。
小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认。老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种。
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是 。
(2)小 亮取少量样品于试管中,滴加 试液,试液变红色,该溶液不可能是
亮取少量样品于试管中,滴加 试液,试液变红色,该溶液不可能是
(填写化学式),理由是 。
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请一起参与,并填写下列实验报告。
[设计实验方案]方案甲:选择氯化钙溶液来确定该溶液的成份;
方案乙:选择稀盐酸来确定该溶液的成份。
[进行实验]你愿意选择方案 (选填“甲”或“乙”)进行实验。
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加 。 | | 该溶液是碳酸钠溶液。 有关反应的化学方程式为:  。 。 |
(2)小亮经过反思,向同学们提出如下建议,你
 认为合理的是 (填序号)。
认为合理的是 (填序号)。A.倾倒液体时应注意保护标签不被腐蚀 B.要有严谨的科学实验的态度
C.无法辨认的药品,直接倒掉,无需保留
 造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验。
造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验。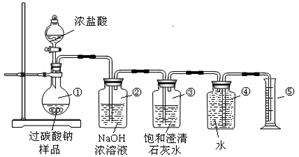
 所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7 g。则该样品的纯度为 ▲ 。
所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7 g。则该样品的纯度为 ▲ 。