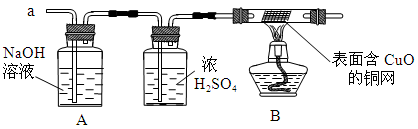
某化学兴趣小组有一次活动的内容是:对一包干燥的红色粉末组成进行探究。请你参与并回答有关问题。
【教师提醒】它由Cu 、Fe2O3、Fe(OH)3三种固体中的一种或两种组成。
【提出猜想】红色粉末可能的组成有:
①只有Cu ②只有Fe2O3
③只有Fe(OH)3 ④是Fe2O3、Fe(OH)3的混合物
⑤是Cu 、Fe2O3的混合物 ⑥是Cu 、Fe(OH)3的混合物
【资料获悉】(1)2Fe(OH)3 Fe2O3 +3H2O
Fe2O3 +3H2O
(2)白色无水CuSO4遇水变蓝
(3)Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
【探究思路】利用物质的性质不同设计实验加以甄别,先分别探究其中是否含有Fe(OH)3、Cu等,逐步缩小范围,然后再选择适当的试剂和方法通过实验探究其组成。
(装置内空气中的水蒸气、CO2忽略不计)
【实验探究】
(1)甲同学取适量红色粉末装入试管中,按图28-1进行实验。结果无水CuSO4没有变蓝,从而排除猜想中的 。(填猜想中的序号)
(2)在甲同学实验结论的基础上,乙同学另取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解,溶液变色。乙同学认为可以排除猜想中的①和⑤,而丙同学认为只能排除猜想①,你认为 的观点正确(填“乙”或“丙”)。
(3)丁同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按图28-2在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却。反应前后称量相关装置和物质的总质量,其数据如下表:
| | 反应前 | 反应后 |
| Ⅰ组 | 玻璃管和红色粉末的总质量为37.3 g | 玻璃管和固体物质的总质量为36.1 g |
| Ⅱ组 | 洗气瓶和所盛溶液的总质量为180.0 g | 洗气瓶和瓶中物质的总质量为183.1 g |
(1)在装置A中先通CO气体的作用是 。
(2)应该选择 组的实验数据计算来确定红色粉末的组成。最终计算结果表明:该红色粉末的组成是猜想中的第 组(填序号)。
(3)写出A装置中发生反应的化学方程式 ;实验中观察到A装置中的现象为 。
(4)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处? (填“需要”或“不需要”),理由是 。
【反思评价】 戊同学指出:从环保角度,图28-2装置有严重不足之处。你认为应该如何改进? 。
【拓展延伸】有同学提出丁同学上述实验中的CO还可以用H2代替,并将图28-2中B装置换成盛有碱石灰(生石灰和氢氧化钠固体混合物)的干燥管,来确定该红色粉末的组成,你认为是否可行? (填“可行”或“不可行”)
(8分)用盐酸和碳酸钙固体反应,将得到的气体X通入澄清石灰水中,始终没有发现石灰水变浑浊。针对此现象,同学们提出了自己的想法。
[查资料]稀盐酸与AgNO3溶液发生复分解反应,AgCl为白色且难溶于水。
[假设]小明的假设:澄清石灰水已变质。
小白的假设:气体X中除了有CO2外,还有 。
[实验探究](1)小明的探究:
| 实验目的 | 实验步骤 | 可能的实验现象 | 化学方程式和实验结沦 |
| 探究所用 澄清石灰 水是否变 质 | ①用一支试管另取少量原澄清石灰水 ②取稀硫酸与碳酸钠反应制取CO2 ③ | 步骤③中现象为: | 步骤②中反应方程式为: 实验结论:所用的澄清石灰水没有变质。 |
| 实验目的 | 实验步骤 | 实验现象 | 化学方程式和实验结论 |
| 探究小白的假设是否成立 | 将气体X通入AgNO3溶液 | | 反应方程式为: 实验结论:小白的假设成立 |
(3)同学们经过讨论发现,用下面实验装置就可以同时完成上述两个假设的探究。

A B C
A、B中都加AgNO3溶液,通X气体后:如果A浑浊、B澄清、C浑浊,结论是 ;如果看到 现象;小明和小白的假设都成立。
(7分)某实验小组将制作皮蛋的原料生石灰、纯碱和食盐放入水中,充分反应后过滤,得到澄清溶液。对该溶液的组成,甲、乙同学分别做出以下推测:
甲同学推测:有食盐,还有反应生成的氢氧化钠和碳酸钙。
乙同学推测:有氢氧化钠、氢氧化钙、碳酸钠和氯化钠。
(1)丙同学认为上述两位同学的推测都有不足,理由是 。
(2)丙同学的推测是:该溶液中一定存在的溶质是___________。为进一步确定该溶液所有可能的组成,还需设计实验并填写下表(可不填满,也可补充)。
| 实验操作 (填所加试剂的化学式) | 实验现象 | 实验结论 | 该溶液的组成 | ||
   | | | | ||
   | | | | ||
| | | | |
(9分)请你参与某学习小组进行研究性学习的过程,并协助完成相关任务:
【研究课题】:探究热水壶底部水垢的主要成分
【查阅资料】:该小组同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热时,这些离子趋于生成溶解度更小的物质—水垢(主要成分为碳酸盐、碱等的混合物)。同时,他们还查阅到下列有关物质的溶解性:
| 物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
【设计方案】:
⑴ 甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入 ,没有白色沉淀,说明水垢中无Ca(OH)2;
⑵ 乙同学设计下列实验装置,进一步确定水垢中含有碳酸盐的成分,步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,加入足量某酸溶液;
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变。


a.步骤①所加的酸溶液是 。
b.装置Ⅱ的作用是 ;
从导管A处缓缓鼓入一定量的空气的作用是____________________。
c.研究性小组的同学通过简单计算,认为水垢中一定含有MgCO3,理由是 。
【实验结论】通过上述探究可知:水垢的主要成分有 。
(6分)今年春节前夕,我国北方遭遇冰雪灾害。为了清除道路上的冰雪,有关部门投入了大量工业盐融雪剂用于除冰雪。同学们从新闻中得知:①使用工业盐融雪剂后,道路两旁树木、农作物大量死亡;②桥梁路面除冰不得使用工业盐融雪剂。
【提出问题】工业盐融雪剂对树木、农作物和桥梁为什么会造成危害?
【查找资料】(1)工业盐的主要成分是NaCl和NaNO2。
(2)土壤盐碱化会造成树木、农作物死亡。
【提出猜想】猜想一:工业盐溶液可能显碱性;
猜想二:工业盐溶液对钢铁可能有更强的腐蚀性。
【实验探究】同学们对猜想一和猜想二进行了探究,请你帮他们完成下列实验报告:
| | 实验操作 | 实验现象 | 实验结论 |
| 猜 想 一 | ________________________________ ________________________________。 | _______________。 | 工业盐溶液显碱性,会造成道路两旁的土壤盐碱化。 |
| 猜想 二 |  实验① 实验② (请将液体名称填在上面的横线上) | 实验①:6—7天后明显生锈。 实验②: 2—3天后明显生锈。 | __________________ __________________ ________________。 |
对于道路除冰,请你提出更好的建议 。
(5分)根据下表内容进行活动与探究,请你参与并回答问题:
| 实验 名称 | (1)空气中氧气含量的测定 |
| 实验 设计 |  (燃烧匙中的药品为红磷) (燃烧匙中的药品为红磷) |
| 问题 与结论 | ①该实验应用的化学方程式为: ; ②实验中应该观察到的现象是: 。 |
| 实验 名称 | (2)一氧化碳还原氧化铁 |
| 实验 设计 | 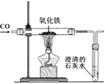 |
| 问题 与结 论 | ①写出氧化铁被还原成铁的反应化学方程式 ; ②从环保角度分析,该装置有明显的缺陷,你认为是 ; ③用该图所示装置进行实验时,石灰水所起的作用是 。 |
探究实验(共8分)

二氧化碳的溶解性实验 氢氧化钠溶解于水
A B
(1)探究物质性质
上述A、B两个实验都是通过___ ____的变化来间接感知。B实验中___ ____(填a或b)处的水位升高的。
(2)探究可燃物燃烧条件
探究燃烧的条件
实验中探究可燃物的燃烧条件,它是通过控制可燃物是否与氧气接触和控制___ ____ 来探究可燃物燃烧的条件。能证明燃烧必须与氧气接触的实验现象是_____ _____;采用了___ ____的实验手段
(3)物质性质的应用:
| 实验序号 | 实验目的 | 实验方案 | 实验现象 | 结论 |
| 实验1 | ___ ____ |  | ___ ____ | 草木灰的主要成分是碳酸钾 |