通过下图所示实验可以得出的结论,其中不合理的是
| A.甲实验既可探究可燃物的燃烧条件,又可以说明白磷的着火点比红磷低 |
| B.乙实验既可以说明分子在不停的运动着,又可以说明浓氨水具有挥发性 |
| C.丙实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性 |
| D.丁实验可以说明氧气能助燃 |
右图是同学们利用大可乐瓶设计的储气装置(铁架台未画出),以下说法不正确的是 
| A.储存气体时,打开止水夹a、b,气体从d管进入储存在下面的瓶子里,水被压入上瓶 |
| B.取用气体时,可通过控制止水夹a、b,靠水的重力方便地将气体从c管排出 |
| C.气体被储存在装置中,c导管不必安装止水夹 |
| D.该装置也可用于实验室制取二氧化碳的发生装置,通过打开、关闭b,可以使反应随时发生、停止 |
实验室里有一瓶标签残缺的酸,为能立即确定它是否为盐酸,你认为下列做法合理的是
| A.猜想假设 | B.查阅资料 | C.进行试验 | D.交流讨论 |
实验室有一瓶标签残缺的试剂可能是浓盐酸,有同学提出打开瓶塞观察。这属于科学探究中的 ( )
| A.猜想假设 | B.收集证据 | C.设计实验 | D.得出结论 |
下表所给出的各组概念中,不符合右图所示从属关系的是
| | X | Y | Z |
| A | 饱和溶液 | 溶液 | 混合物 |
| B | 氧化物 | 化合物 | 纯净物 |
| C | 中和反应 | 复分解反应 | 化学反应 |
| D | 稀有气体元素 | 金属元素 | 元素 |
印刷铜制电路板的“腐蚀液”为FeCl3溶液。已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2。现将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是
| A.溶液中一定含FeCl2,固体一定含铜 |
| B.溶液中一定含FeCl2,固体一定是铁和铜 |
| C.溶液中一定含FeCl3,固体一定是铁和铜 |
| D.溶液中一定含FeCl2、CuCl2,固体一定含铜 |
在实验探究过程中,如果有多种因素同时影响某一实验结果,当我们要探究其中的一种因素时,就要使其他因素保持不变,以探究此种因素对实验结果的影响。下表是稀硫酸与某金属反应的实验数据:
通过分析上述数据得出的结论不正确的是:
| A.对比实验1和2、4和5,可得出固体反应物的表面积越大,反应越快的结论。 |
| B.表明反应物的溶质质量分数越大,反应越快的只有2和5 |
| C.表明反应体系的温度越高,反应越快的只有6和7。 |
| D.实验中的所有反应,反应前后溶液的温度变化值相近(约15℃),推测其原因是:所有反应中,金属质量和硫酸体积均相等,且金属完全反应,产生热量相等,所以溶液温度变化值相近。 |
若在试剂瓶中放入某种物质,先滴加滴管1中液体后,小气球变鼓,再滴加滴管2中液体后,小气球又变瘪。下列与所描述现象相符的一组是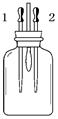
| | 试剂瓶中的物质 | 滴管中的物质 | |
| 滴管1 | 滴管2 | ||
| A | 冰 | 水 | 稀硫酸 |
| B | 稀盐酸 | 碳酸氢钠溶液 | 浓硫酸 |
| C | 生石灰 | 水 | 稀盐酸 |
| D | 二氧化碳 | 氢氧化钠溶液 | 稀盐酸 |
实验室里有一瓶标签残缺的酸,为能立即确定它是否为盐酸,你认为下列做法合理的是 ( )
| A.猜想假设 | B.查阅资料 | C.进行试验 | D.交流讨论 |
根据反应事实可以推出影响化学反应的因素,下列推理中不合理的是
| 选项 | 化学反应事实 | 影响因素 |
| A. | 蜡烛在纯氧中燃烧的火焰比在空气中燃烧的火焰更明亮 | 反应物浓度 |
| B. | 煤粉比煤块燃烧的更加剧烈、更加充分 | 反应物种类 |
| C. | 碳在常温下不与氧气反应,点燃时能与氧气反应 | 反应温度 |
| D. | 双氧水在通常情况下难分解,加入二氧化锰后迅速分解 | 催化剂 |