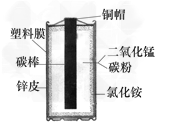
【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】 化学反应前后各物质的质量总和是否相等?
【查阅资料】 氢氧化钠溶液可以吸收二氧化碳气体
【猜想与假设】 猜想1:不相等;猜想2:相等。
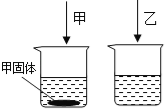
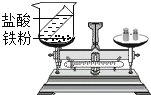
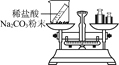
【实验探究】 甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | |
实验方案(反应后略) |
|
|
实验现象 | 有气泡产生,天平指针向右偏转 | _________,天平指针没有偏转 |
结论 | 猜想1正确,反应的化学方程 式:_______________. | 猜想2正确 |
【反思评价】 究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在_______________中进行。
【优化装置】 同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是(填序号)___,从另外两种装置中任选一种指出其不足:________。
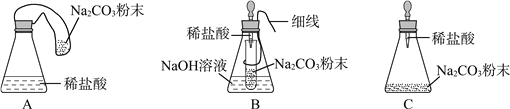
【得出结论】 同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步
分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:_________________________的各物质的质量总和等于反应后生成的各物质的质量总和。
【解释应用】
解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由_________种元素组成。
【题目】西藏“茶马古道”芒康县盐井是香格里拉唯一的产盐区。盐田是用紫红色粘土抹平压实的晒盐池,当地人把卤水注入盐田中经过日晒风吹,就得到上等且味道很好的红盐。为揭密红盐呈红色的原因,实验小组进行了如下探究活动。
(提出问题)红盐中存在什么物质使盐呈现红色?
(查找资料)
1、西藏紫红色粘土中含大量的氧化铁(Fe2O3)。
2、溶液中三价铁离子(Fe3+)遇到硫氰化钾(KSCN)溶液,溶液变为血红色。
(作出猜想)红盐中含少量的氧化铁使盐呈现红色;
(实验探究)小组同学从一定量的红盐中提取少量红色粉末,进行如下实验:
实验操作 | 实验现象 | 实验解释与结论 | |
实验I | 步骤①:取少量红色粉末于试管中,滴加适量稀盐酸; | 红色粉末恰好全部溶解; | 红色粉末中含有_____;步骤①涉及的反应的化学方程式_____ |
步骤②:往①所得溶液中滴入硫氰化钾(KSCN)溶液。 | 溶液变为血红色 | ||
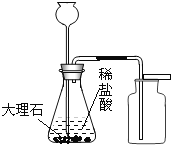
实验Ⅱ | 步骤①:如图所示,将红色粉末与足量的黑色炭粉混合均匀,装入玻璃管中,先通一段时间氮气,再加热。
| 一定时间后,观察到澄清石灰水变浑浊,红色粉末变黑色 | 反应产生的气体为_____;红色粉末中一定含_____元素 |
步骤②:冷却后,取出玻璃管中黑色粉末,将磁铁靠近黑色粉末 | 黑色粉末部分被吸引 | 红色粉末中一定含_____元素 |
(实验结论)猜想_____(填写“正确”或“错误”)。
(实验反思)实验Ⅱ中能否用CO气体代替黑色炭粉并说明理由_____。