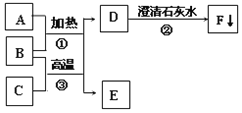
【题目】某化学兴趣小组用如图所示装置制取氧气,试管中固体的质量随时间变化的数据见下表。
加热时间/min | 0 | t1 | t2 | t3 |
固体质量/g | 26.5 | 18.7 | 16.9 | 16.9 |

(1)当反应完全后,共制得氧气______g。
(2)制取结束后,将剩余固体用适量水充分溶解过滤,得到的滤液中的溶质是______。
(3)将所得的滤液加水稀释到500g,求溶质的质量分数是____?(写出计算过程)
【题目】稀土是一种重要的战略资源。铈是一种常见的稀土元素,下列有关铈的说法正确的是

A. 铈属于非金属元素
B. 铈原子的中子数是58
C. 铈原子的核外电子数是58
D. 铈原子的相对原子质量是140.1g
【题目】石家庄28中化学兴趣小组的同学在学习九年级《化学》下册中的资料卡片“石笋和钟乳石的形成”时,发现难溶于水的碳酸钙当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2,联想到实验室中澄清石灰水与二氧化碳反应会生成碳酸钙:Ca(OH)2+CO2=CaCO3↓+H2O,对长时间向碱溶液中通入CO2反应后溶液中的溶质组成产生了浓厚的兴趣。
(提出问题)一定量CO2与NaOH溶液反应后的溶质组成是什么?
(查阅资料)(1)通入少量CO2反应的化学方程式为:___。
(2)通入过量CO2,反应的化学方程式为:Na2CO3+CO2+H2O=2NaHCO3。
(3)碳酸氢盐都是可溶于水的,BaCO3难溶于水。
(4)碳酸氢钠溶液呈碱性。
(提出猜想)(1)溶质为NaOH和Na2CO3; (2)溶质为Na2CO3;(3)溶质为___(填化学式);(4)溶质为NaHCO3。
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
(1)用玻璃棒蘸取反应后溶液,滴在pH试纸上 | pH=9 | 该溶液显碱性 |
(2)取反应后溶液少许于试管中,向其中滴加过 量的___溶液 | 有___生成 | 猜想(4)不成立 |
(3)取步骤(2)中的上层清液,滴入稀盐酸 | 有气泡冒出 | 猜想(1)和(2) 不成立 |
(得出结论)猜想(3)成立。
(讨论交流)(1)有同学提出,实验步骤(1)是多余的,你认为该实验设计是否需要,___(填“需要”或“不需要”)。
(2)同学们又一次把目光投向了教材,发现遇热或压强变小时:Ca(HCO3)2=CaCO3↓+CO2↑+H2O,纷纷提出,干粉灭火器中用NaHCO3灭火的反应原理与之相似,试写出NaHCO3受热分解的化学方程式:__。
(反思应用)同学们回忆起实验室检验二氧化碳的情景,心想:如果向澄清石灰水中不断通入二氧化碳,会看到怎样的现象呢?请你描述一下:___。
【题目】为了探究相同条件下同种溶质在不同溶剂中的溶解性,某兴趣小组同学进行如下实验。(提示:本实验汽油与碘均不发生化学反应)
实验:碘在不同溶剂中的溶解实验根据实验操作图示回答相关问题。
实验操作图示 | 实验结论或解释 |
| (1)由图 2 所示现象可知:碘___ (选填“不”、“微”、或“易”)溶于水 (2)图3所示试管中液体分层。上层紫红色溶液的名称是___。说明碘在汽油中的溶解性比在水中___(选填“强”或“弱”) |
(反思与应用)
(3)①碘易溶于酒精。若实验中汽油用酒精代替,振荡后静置,最终所得液体___(选填“分层”或“不分层”)。
②“从稀碘水巾提取碘”是“海带提碘”工艺巾的一个重要步骤,其原理类似实验中第二步操作。工业实际生产时使用其他挥发性液体代替汽油,这种挥发性液体必须具备的条件是___。