10.下列实验设计,不能达到实验目的是( )
| 选项 | 实验目的 | 实验设计 |
| A | 鉴别蒸馏水与氯化钾溶液 | 取样后,加热蒸发 |
| B | 检验废水中是否含有Cl- | 取样后,滴加AgNO3溶液和稀硝酸 |
| C | 鉴别硬水和软水 | 取样后,分别加入肥皂水,振荡 |
| D | 除去CO2中的CO | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
9.丙三醇(C3H8O3)俗名甘油,是化妆品中的保湿剂,下列看法错误的是( )
| A. | 从组成上看:丙三醇由碳、氢、氧三种元素组成 | |
| B. | 从结构上看:丙三醇由3个碳原子、8个氢原子和3个氧原子构成 | |
| C. | 从物质类别上看:丙三醇是含氧化合物 | |
| D. | 从变化上看:丙三醇完全燃烧生成水和二氧化碳 |
8.下列比较中,不符合实际的是( )
| A. | 分子比原子大 | |
| B. | 化肥NH4H2PO4比NH4NO3 营养元素种类多 | |
| C. | 生铁比纯铁硬度大 | |
| D. | 金刚石硬度比石墨大 |
7.小强同学的化学笔记本上有如下记录,你认为不正确的是( )
| A. | 化学反应前后原子的个数和种类都不变 | |
| B. | 催化剂在化学反应前后本身的质量和化学性质没有发生变化 | |
| C. | 氧气用于火箭发射,是利用氧气的可燃性 | |
| D. | 洗涤剂用于去油污,是因为它具有乳化作用 |
6.下列灭火原理与其他三种不同的是( )
| A. | 油罐着火时用水喷淋 | B. | 森林着火时砍掉树木形成隔离带 | ||
| C. | 釜底抽薪 | D. | 熄灭蜡烛时剪去烛芯 |
5.氯化钠是重要的调味品,炒菜时如果不放食盐,菜将食之无味.除此之外氯化钠还可以用来( )
| A. | 做补钙剂 | B. | 做发酵粉 | C. | 配制选种液 | D. | 治疗胃酸过多症 |
4.雾霾天气会对肺脏造成损伤,多吃富含维生素的食物可以达到清肺、养肺的功效.下列食物中,最有利于应对雾霾天气的是( )
| A. | 小面 | B. | 鲜榨西瓜汁 | C. | 凉糕 | D. | 鲜牛奶 |
3.自然界的水都不是纯水,日常生活用水需经自来水厂净化处理.下列净水过程中,发生了化学变化的是( )
| A. | 取水 | B. | 静置沉淀 | ||
| C. | 活性炭吸附 | D. | 将氯气通入水中杀菌消毒 |
2.实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行了探究.

【实验探究1】
(1)为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
【实验探究2】为了测定样品中Na2CO3的质量分数,亮亮同学设计如图装置(铁架台略去)按下列步骤进行实验.
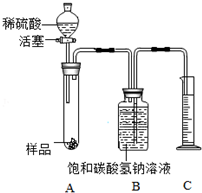
①按图连接好装置并检查装置气密性;
②用托盘天平准确称取6g该样品,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞;反应结束后,量筒中收集到溶液110mL.
(2)写出A中发生反应的一个化学方程式为2NaOH+H2SO4=Na2SO4+2H2O.
(3)实验中取用样品的质量不宜过多,如果样品用量过多,造成的后果是样品过多,中和反应放热太多使得气体膨胀,测量误差偏大;
(4)已知在实验条件下,二氧化碳的密度为2g•L-1,则生成CO2的质量为0.22g,样品中碳酸钠的质量分数为88.3%.
(5)实验过程中,操作正确,装置气密性良好,Na2CO3质量分数仍将偏大(填“偏大”或“偏小”),理由是加入硫酸溶液的体积也将计入二氧化碳的体积,造成碳酸钠偏多,所以碳酸钠的质量分数偏大.
【实验探究3】为了得到较纯净的氢氧化钠固体,杨明同学设计了如图所示的实验流程.
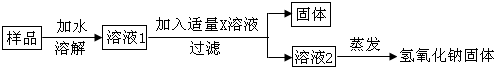
(6)加入适量X溶液是Ca(OH)2溶液.
(7)最终所得氢氧化钠固体的质量大于变质样品中氢氧化钠的质量(选填“大于”、“等于”或“小于”).

【实验探究1】
(1)为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| (a)取少量样品于试管中,加水溶解后,加入过量的氯化钙溶液; | 有白色沉淀产生 | 样品中含有碳酸钠 |
| (b)静置,取上层清液于试管中,滴加酚酞试液. | 溶液变红色 | 样品中含有氢氧化钠 |

①按图连接好装置并检查装置气密性;
②用托盘天平准确称取6g该样品,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞;反应结束后,量筒中收集到溶液110mL.
(2)写出A中发生反应的一个化学方程式为2NaOH+H2SO4=Na2SO4+2H2O.
(3)实验中取用样品的质量不宜过多,如果样品用量过多,造成的后果是样品过多,中和反应放热太多使得气体膨胀,测量误差偏大;
(4)已知在实验条件下,二氧化碳的密度为2g•L-1,则生成CO2的质量为0.22g,样品中碳酸钠的质量分数为88.3%.
(5)实验过程中,操作正确,装置气密性良好,Na2CO3质量分数仍将偏大(填“偏大”或“偏小”),理由是加入硫酸溶液的体积也将计入二氧化碳的体积,造成碳酸钠偏多,所以碳酸钠的质量分数偏大.
【实验探究3】为了得到较纯净的氢氧化钠固体,杨明同学设计了如图所示的实验流程.

(6)加入适量X溶液是Ca(OH)2溶液.
(7)最终所得氢氧化钠固体的质量大于变质样品中氢氧化钠的质量(选填“大于”、“等于”或“小于”).
1.下列有关实验操作、现象或结论的描述正确的是( )
0 164758 164766 164772 164776 164782 164784 164788 164794 164796 164802 164808 164812 164814 164818 164824 164826 164832 164836 164838 164842 164844 164848 164850 164852 164853 164854 164856 164857 164858 164860 164862 164866 164868 164872 164874 164878 164884 164886 164892 164896 164898 164902 164908 164914 164916 164922 164926 164928 164934 164938 164944 164952 211419
| A. | 铁丝在空气中燃烧火星四射,生成黑色的四氧化三铁 | |
| B. | 氢氧化钠固体不能放在纸上、也不能直接放在天平的托盘上称量,可放在烧杯中称量 | |
| C. | 稀释浓硫酸:将水沿烧杯壁慢慢倒入盛有浓硫酸的烧杯中,并用玻璃棒不断搅拌 | |
| D. | 棉线和羊毛线灼烧时,都有烧焦羽毛气味 |