16.把质量为100g的铁棒伸入盛有一定量CuSO4溶液烧杯中,充分反应后,取出干燥称量102g,则参加反应的铁的质量为 ( )
| A. | 14g | B. | 8g | C. | 28g | D. | 4g |
14.将硫酸渣中金属元素进行分离的一种工艺 流程如图所示.

【查阅资料】
Ⅰ.相关数据
25℃时,氢氧化物沉淀的pH范围
Ⅱ.25℃时,Al(OH)3可溶于pH>6.0的碱溶液,并转化为AlO2-
【流程分析】
(1)在实验室完成操作①需要的玻璃仪器有烧杯、玻璃棒和漏斗.
(2)所加稀盐酸必须过量的原因是使硫酸渣完全溶解.
(3)向溶液A中加入试剂M调节pH到7的过程中,沉淀的颜色会经历“红褐色变淡,再变深的过程”的过程,出现该现象的原因是氢氧化钠会与氯化铁反应生成氢氧化铁沉淀,氢氧化铁沉淀会溶于酸,盐酸消耗完后,氢氧化铁沉淀的沉淀量会逐渐增多,颜色变深.
(4)溶液B中加入试剂M调节pH=13时,发生反应的化学方程式是AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
(5)高温灼烧固体X时,X能在保持各元素的化合价不变的前提下分解为两种氧化物,该反应的化学方程式是2Fe(OH)3$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2O.
(6)如果操作②是蒸发结晶,则不可能得到纯净的NaAlO2固体,理由是溶液C中含有反应生成的氯化钠.
Ⅲ.1000t该硫酸渣含铁的质量分数37.75%,经过充分处理后,最多可以冶炼得到含杂质4%的生铁多少吨?

【查阅资料】
Ⅰ.相关数据
25℃时,氢氧化物沉淀的pH范围
| Fe(OH)3 | Al(OH)3 | Mg(OH)2 | |
| 开始沉淀时的pH | 1.5 | 3.3 | 10.4 |
| 沉淀完全时的pH | 3.2 | 5.2 | 12.4 |
【流程分析】
(1)在实验室完成操作①需要的玻璃仪器有烧杯、玻璃棒和漏斗.
(2)所加稀盐酸必须过量的原因是使硫酸渣完全溶解.
(3)向溶液A中加入试剂M调节pH到7的过程中,沉淀的颜色会经历“红褐色变淡,再变深的过程”的过程,出现该现象的原因是氢氧化钠会与氯化铁反应生成氢氧化铁沉淀,氢氧化铁沉淀会溶于酸,盐酸消耗完后,氢氧化铁沉淀的沉淀量会逐渐增多,颜色变深.
(4)溶液B中加入试剂M调节pH=13时,发生反应的化学方程式是AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
(5)高温灼烧固体X时,X能在保持各元素的化合价不变的前提下分解为两种氧化物,该反应的化学方程式是2Fe(OH)3$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2O.
(6)如果操作②是蒸发结晶,则不可能得到纯净的NaAlO2固体,理由是溶液C中含有反应生成的氯化钠.
Ⅲ.1000t该硫酸渣含铁的质量分数37.75%,经过充分处理后,最多可以冶炼得到含杂质4%的生铁多少吨?
12.某学校研究性学习小组为了测定当地矿山中碳酸钙的质量分数,取来了15g矿石样品于一容器中,并取稀盐酸200g,平均分成4份,分次加入进行实验(石灰石中的杂质不溶于水且不和酸发生反应),结果结果记录如下,试计算:
(1)上表中m的数值是5.
(2)石灰石中碳酸钙的质量分数.
(3)实验中所用稀盐酸的溶质质量分数.
0 163299 163307 163313 163317 163323 163325 163329 163335 163337 163343 163349 163353 163355 163359 163365 163367 163373 163377 163379 163383 163385 163389 163391 163393 163394 163395 163397 163398 163399 163401 163403 163407 163409 163413 163415 163419 163425 163427 163433 163437 163439 163443 163449 163455 163457 163463 163467 163469 163475 163479 163485 163493 211419
| 加入稀盐酸的质量/g | 50 | 50 | 50 | 50 |
| 剩余固体的质量/g | 11 | 7 | 5 | m |
(2)石灰石中碳酸钙的质量分数.
(3)实验中所用稀盐酸的溶质质量分数.
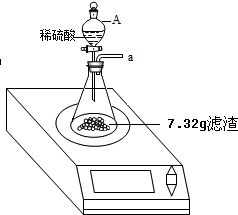 某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
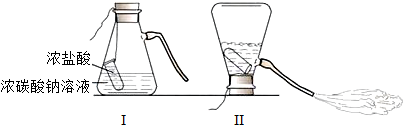 某化学兴趣小组的同学学习“灭火器原理”后,设计了如图所示实验,并对反应后瓶中残留废液进行探究.
某化学兴趣小组的同学学习“灭火器原理”后,设计了如图所示实验,并对反应后瓶中残留废液进行探究.