14.如图为元素周期表中的一格,对图中信息解释正确的是( )
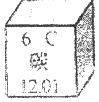

| A. | 核外电子数为12 | B. | 碳原子核内质子数为12 | ||
| C. | 核外电子数为6 | D. | 碳的相对原子质量为12.01g |
13.某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①无水硫酸铜是白色固体,吸水变蓝.
②生产原料粗盐中含有少量可溶性杂质(MgCl2和CaC12)及不溶性杂质.
③生产原理:NaCl+NH3+CO2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NaHCO3↓+NH4C1.分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物.
④氯化铵分解的化学方程式是NH4Cl═NH3↑+HCl↑.
⑤部分生产流程如下图所示:
【问题讨论】
(1)①溶液A中的溶质有NaCl和NaOH、Na2CO3.
②操作Ⅱ的名称为过滤.
③写出加入NaOH溶液所发生反应的化学方程式MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
④流程中Na2CO3溶液的作用是除去粗盐中的CaCl2.
(2)上述生产流程中可循环使用的是ACD (填序号).
A.NH3 B.NaOH C.HCl D.CO2
【组成探究】
(3)①晶体A受热分解的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
②设计实验检验纯碱样品中是否混有晶体A,请完成下表(从下图装置中选择):
【组成探究二】
(4)取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为AgNO3+NaCl=AgCl↓+NaNO3,由此确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①氯化钡溶液过量的目的是使碳酸钠完全反应.
②判断滤渣是否洗干净,可向最后的洗出液中滴加BD,然后观察现象判断.
A.氯化钡溶液 B.稀硫酸 C.稀盐酸 D.碳酸钾溶液
③根据实验数据,计算样品中碳酸钠的质量分数为88.3%.(精确到0.1% )
0 158042 158050 158056 158060 158066 158068 158072 158078 158080 158086 158092 158096 158098 158102 158108 158110 158116 158120 158122 158126 158128 158132 158134 158136 158137 158138 158140 158141 158142 158144 158146 158150 158152 158156 158158 158162 158168 158170 158176 158180 158182 158186 158192 158198 158200 158206 158210 158212 158218 158222 158228 158236 211419
【查阅资料】
①无水硫酸铜是白色固体,吸水变蓝.
②生产原料粗盐中含有少量可溶性杂质(MgCl2和CaC12)及不溶性杂质.
③生产原理:NaCl+NH3+CO2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NaHCO3↓+NH4C1.分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物.
④氯化铵分解的化学方程式是NH4Cl═NH3↑+HCl↑.
⑤部分生产流程如下图所示:

【问题讨论】
(1)①溶液A中的溶质有NaCl和NaOH、Na2CO3.
②操作Ⅱ的名称为过滤.
③写出加入NaOH溶液所发生反应的化学方程式MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
④流程中Na2CO3溶液的作用是除去粗盐中的CaCl2.
(2)上述生产流程中可循环使用的是ACD (填序号).
A.NH3 B.NaOH C.HCl D.CO2
【组成探究】
(3)①晶体A受热分解的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
②设计实验检验纯碱样品中是否混有晶体A,请完成下表(从下图装置中选择):

| 选择的装置 | 实验现象 | 实验结论 |
| AB,或AC,或ABC | B中不变浑浊,或C中不变蓝,或B中不变浑,C中不变蓝 | 样品不含晶体A |
(4)取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为AgNO3+NaCl=AgCl↓+NaNO3,由此确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①氯化钡溶液过量的目的是使碳酸钠完全反应.
②判断滤渣是否洗干净,可向最后的洗出液中滴加BD,然后观察现象判断.
A.氯化钡溶液 B.稀硫酸 C.稀盐酸 D.碳酸钾溶液
③根据实验数据,计算样品中碳酸钠的质量分数为88.3%.(精确到0.1% )

 如图为A、B、C三种物质的溶解度曲线,据图回答:
如图为A、B、C三种物质的溶解度曲线,据图回答: