14.下列微粒中,能表示2个氢分子的是( )
| A. | 2H2 | B. | 2H | C. | 2H+ | D. | 2H2O |
7.下列实验方案合理的是( )
| A. | 验证碱能与酸反应:将稀盐酸滴入混有酚酞的氢氧化钠溶液中 | |
| B. | 检验碳酸根离子:将要检验的物质与稀盐酸混合,观察是否产生气泡 | |
| C. | 验证质量守恒定律:将锌粒与稀硫酸混合,比较混合前后溶液的质量 | |
| D. | 鉴别H2、CO、CH4三种气体:分别将燃着的木条伸入集气瓶内,观察现象 |
6.区分日常生活中的下列各组物质,所加试剂或操作方法完全正确的是( )
0 157650 157658 157664 157668 157674 157676 157680 157686 157688 157694 157700 157704 157706 157710 157716 157718 157724 157728 157730 157734 157736 157740 157742 157744 157745 157746 157748 157749 157750 157752 157754 157758 157760 157764 157766 157770 157776 157778 157784 157788 157790 157794 157800 157806 157808 157814 157818 157820 157826 157830 157836 157844 211419
| 需区分的物质 | 方法1 | 方法2 | |
| A | 碳酸钠溶液和氯化钠溶液 | 分别加入石蕊溶液 | 分别加足量氯化钙溶液 |
| B | 食盐水和蒸馏水 | 分别测两种液体的pH | 分别加热蒸发 |
| C | 氧化铁和氧化铜 | 分别观察固体的颜色 | 分别加入足量的稀硫酸 |
| D | 一氧化碳和二氧化碳 | 分别闻气体气味 | 分别通过灼热的氧化铜 |
| A. | A | B. | B | C. | C | D. | D |
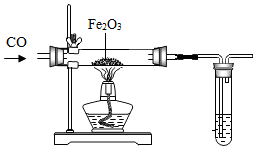 冶炼金属通常是指从矿石中提取金属单质的过程,除“沙土淘金”等物理方法外,金属冶炼大都是使金属从其化合态(化合物)转化为游离态(单质)的化学过程.根据金属的化学性质不同,工业上冶炼金属一般有以下几种方法.
冶炼金属通常是指从矿石中提取金属单质的过程,除“沙土淘金”等物理方法外,金属冶炼大都是使金属从其化合态(化合物)转化为游离态(单质)的化学过程.根据金属的化学性质不同,工业上冶炼金属一般有以下几种方法. 图中A、B、C、M是初中化学常见的不同类别的化合物,其中A是黑色固体(不含铁元素),C与D类别相同,C常温下溶解度很大,D是有色物质,M的浓溶液在实验室常用干燥剂.“--”表示两种相邻物质能发生反应,“→”表示一种物质能转化成另一种物质.请分析回答以下问题:
图中A、B、C、M是初中化学常见的不同类别的化合物,其中A是黑色固体(不含铁元素),C与D类别相同,C常温下溶解度很大,D是有色物质,M的浓溶液在实验室常用干燥剂.“--”表示两种相邻物质能发生反应,“→”表示一种物质能转化成另一种物质.请分析回答以下问题: