3.氧化镁在医药、建筑等行业应用广泛,以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶,也不参加反应)为原料制备高纯氧化镁的实验流程如下:

资料:①不同氢氧化物沉淀的pH范围:
②硫在常温下是一种淡黄色固体,硫的熔点约为115.2℃,沸点约为444.7℃;
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2. 试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是使铁离子完全转化成氢氧化铁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓.
800℃
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)
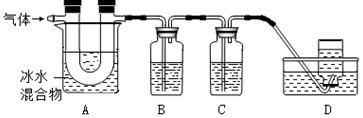
①A中现象是:玻璃管壁出现淡黄色固体;
②B中盛放的溶液可以是a(填字母),实验现象为产生沉淀;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).

资料:①不同氢氧化物沉淀的pH范围:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 8.6 |
| 完全沉淀的pH | 3.2 | 11.1 |
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2. 试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是使铁离子完全转化成氢氧化铁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓.
800℃
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)

①A中现象是:玻璃管壁出现淡黄色固体;
②B中盛放的溶液可以是a(填字母),实验现象为产生沉淀;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).
1.下列有关分子、原子和离子的说法正确的是( )
0 156711 156719 156725 156729 156735 156737 156741 156747 156749 156755 156761 156765 156767 156771 156777 156779 156785 156789 156791 156795 156797 156801 156803 156805 156806 156807 156809 156810 156811 156813 156815 156819 156821 156825 156827 156831 156837 156839 156845 156849 156851 156855 156861 156867 156869 156875 156879 156881 156887 156891 156897 156905 211419
| A. | 分子是保持物质性质的一种粒子 | |
| B. | 物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变 | |
| C. | 分子、原子、离子都可以直接构成物质 | |
| D. | 在化学反应中,任何离子都不能再分 |




