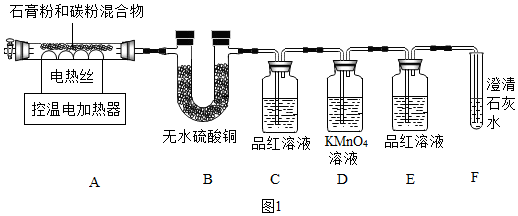
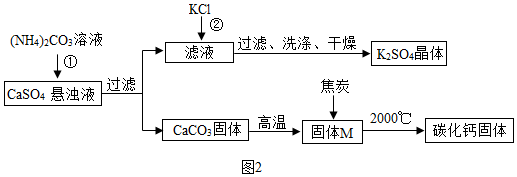
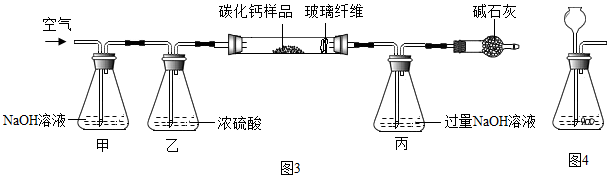
3.正确分析坐标图形和运用表格数据是学习化学的一种重要方法.
(1)如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
①40℃时,氯化钠的溶解度为36.6g;
②在 20℃时,将100g的水加入 30g碳酸钠中,充分搅拌后得到的是饱和溶液(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到 30℃,该溶液的溶质质量分数为23.1% (计算结果精确到 0.1%);
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠饱和溶液;
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式Fe+2HCl═FeCl2+H2↑;
(3)如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是AC (填标号).

(1)如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
②在 20℃时,将100g的水加入 30g碳酸钠中,充分搅拌后得到的是饱和溶液(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到 30℃,该溶液的溶质质量分数为23.1% (计算结果精确到 0.1%);
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠饱和溶液;
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式Fe+2HCl═FeCl2+H2↑;
(3)如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是AC (填标号).

1.下列四个图象的变化趋势,能正确描述对应操作的是( )
| A. |  向NaOH溶液中不断加水 | |
| B. |  煅烧一定质量的石灰石 | |
| C. |  向NaOH和Ba(NO3)2的混合溶液中加稀H2SO4 | |
| D. |  足量的铁片和铝片分别与等质量、等浓度的稀盐酸反应 |
18.归纳法是学习化学最有效的方法之一.下列对部分化学知识的归纳正确的一组是( )
| A 对微粒的认识 | B 对常识的认识 |
| ①氯化钠由钠离子和氯离子构成 ②具有相同质子数的粒子属于同种元素 ③带电的粒子不一定是离子 | ①洗涤剂除去油污是乳化作用 ②塑料、合成纤维和合成橡胶都属于合成材料 ③用水灭火的原理是降低可燃物的着火点 |
| C 对鉴别的认识 | D 对概念的理解 |
| ①区分硬水和软水,加肥皂水 ②区分氯化钾和二氧化锰,加水 ③区分CO2和O2,用带火星的小木条 | ①使紫色石蕊溶液变蓝的不一定是碱溶液 ②氯化铵与草木灰混合使用,可以增加肥效 ③中和反应一定会有盐和水生成 |
| A. | A | B. | B | C. | C | D. | D |
16.完全电解ag水,在正极上得到10mL气体,则在负极上得到的气体的质量和体积分别是( )
| A. | a g,10mL | B. | $\frac{8a}{9}$g,5 mL | C. | $\frac{a}{9}$g,20mL | D. | $\frac{a}{9}$ g,5mL |
14.下列实验方案能达到实验目的是( )
0 156480 156488 156494 156498 156504 156506 156510 156516 156518 156524 156530 156534 156536 156540 156546 156548 156554 156558 156560 156564 156566 156570 156572 156574 156575 156576 156578 156579 156580 156582 156584 156588 156590 156594 156596 156600 156606 156608 156614 156618 156620 156624 156630 156636 156638 156644 156648 156650 156656 156660 156666 156674 211419
| 选项 | 实验目的 | 实验方案 |
| A | 去除粗盐中的难溶性杂质 | 溶解 过滤 洗涤 干燥 |
| B | 证明NaOH溶液部分变质 | 取少量样品,加入过量的氢氧化钙溶液,有白色沉淀生成,过滤,向滤液中加入几滴酚酞试液 |
| C | 证明燃烧条件之一是温度达到可燃物的着火点 | 将白磷放入80℃热水中,不燃烧,通入氧气后白磷燃烧 |
| D | 证明金属的活动性顺序为Fe>Cu>Ag | 将铜丝浸入AgNO3溶液中,表面析出银白色固体;再将另一根铜丝浸入FeSO4溶液中无明显现象 |
| A. | A | B. | B | C. | C | D. | D |