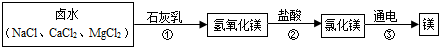
2.实验探究是化学的灵魂,请你参与实验室制取二氧化碳的探究活动.
Ⅰ.制取二氧化碳原料的选择
(1)实验室常用大理石或石灰石(主要成分CaCO3)与稀盐酸反应制取二氧化碳,反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)实验过程中,同学们提出了下列问题,并在老师指导下进行实验.
[问题一]能否用稀硫酸与块状石灰石反应制取二氧化碳?
[实验一]
[分析一]实验室不能(填“能”或“不能”)用稀硫酸与块状石灰石反应制取二氧化碳.
[问题二]能否用粉末状石灰石、碳酸钙粉末或碳酸钠粉末与稀盐酸反应制取二氧化碳?
[实验二]
[分析二]实验室不选用石灰石粉末、碳酸钙粉末或碳酸钠粉末制取二氧化碳的理由是反应速率太快,不利于二氧化碳的收集.
[结论]实验室制取二氧化碳,原料通常用块状石灰石(或大理石)和稀盐酸.
Ⅱ.拓展与反思:通过探究活动,你认为选择实验方法时应考虑的因素有反应速率(写一种).
Ⅰ.制取二氧化碳原料的选择
(1)实验室常用大理石或石灰石(主要成分CaCO3)与稀盐酸反应制取二氧化碳,反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)实验过程中,同学们提出了下列问题,并在老师指导下进行实验.
[问题一]能否用稀硫酸与块状石灰石反应制取二氧化碳?
[实验一]
| 实验步骤 | 实验现象 |
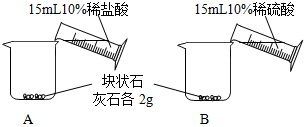 | A中不断产生气泡,固 体逐渐减少,有少量固体 剩余. B中开始有少量气泡产 生,反应很快停止. |
[问题二]能否用粉末状石灰石、碳酸钙粉末或碳酸钠粉末与稀盐酸反应制取二氧化碳?
[实验二]
| 实验步骤 | 实验现象 |
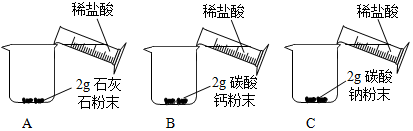 | A中迅速产生大量 气泡,固体很快减少, 有少量固体剩余. B、C中都迅速产生 大量气泡,固体很快 消失. |
[结论]实验室制取二氧化碳,原料通常用块状石灰石(或大理石)和稀盐酸.
Ⅱ.拓展与反思:通过探究活动,你认为选择实验方法时应考虑的因素有反应速率(写一种).
1.Ⅰ、甲、乙同学分别用图1实验装置,使用二氧化锰固体与过氧化氢溶液在常温下作用制取氧气.
①写出图1装置甲中仪器X名称集气瓶,仪器y名称水槽;甲装置中有一个错误,请指出双氧水制氧气收集装置中导气管下端没有插入到集气瓶的下部.
②从图1两个装置中,你能得出氧气的性质有:氧气密度比空气大(请写一点);
③写出该实验制取氧气的文字表达式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
④某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究.他们进行了以下实验:
A.往盛有5mL 5% H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
B.往盛有5mL w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃.
C.往盛有5mL w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃.
D.经检验,B、C 中反应后试管中仍分别含有a g MnO2和a g Fe2O3.
问题:(1)MnO2、Fe2O3在上述反应中的作用是催化.
(2)实验 B、C 中H2O2的浓度(w%)以5%为宜.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需的时间
问题:(3)从表中能得出下列结论:相同条件下,MnO2的催化效果比Fe2O3好(填“好”或“差”);在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快.
Ⅱ、丙同学只用5% H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃.同学们经过认真观察、讨论,制定了实验方案并进行实验:
注:浓硫酸是一种重要的气体干燥剂,遇水会放出大量的热,且具有强腐蚀.
①第一组同学采取改变H2O2溶液质量分数的方法.用10%的H2O2溶液加热,反应一段时间后,用带火星的木条检验,木条复燃.
②第二组同学对实验装置进行改进,效果很好,如图2所示.用带火星的木条检验,也能使带火星的木条复燃.
从上面的实验结果中,你能得到的结论是:收集到的氧气含量(或浓度)不足或含有水蒸气时,不易使带火星的木条复燃.
实验反思:实验结束后应先B.(填序号)
A.熄灭酒精灯 B.拔掉试管口上的单孔塞.

①写出图1装置甲中仪器X名称集气瓶,仪器y名称水槽;甲装置中有一个错误,请指出双氧水制氧气收集装置中导气管下端没有插入到集气瓶的下部.
②从图1两个装置中,你能得出氧气的性质有:氧气密度比空气大(请写一点);
③写出该实验制取氧气的文字表达式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
④某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究.他们进行了以下实验:
A.往盛有5mL 5% H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
B.往盛有5mL w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃.
C.往盛有5mL w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃.
D.经检验,B、C 中反应后试管中仍分别含有a g MnO2和a g Fe2O3.
问题:(1)MnO2、Fe2O3在上述反应中的作用是催化.
(2)实验 B、C 中H2O2的浓度(w%)以5%为宜.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需的时间
| 浓度 时间(min) 条件 | 30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |
| 加入a g Fe2O3 | 7.0 | 9.0 | 16.0 |
Ⅱ、丙同学只用5% H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃.同学们经过认真观察、讨论,制定了实验方案并进行实验:
注:浓硫酸是一种重要的气体干燥剂,遇水会放出大量的热,且具有强腐蚀.
①第一组同学采取改变H2O2溶液质量分数的方法.用10%的H2O2溶液加热,反应一段时间后,用带火星的木条检验,木条复燃.
②第二组同学对实验装置进行改进,效果很好,如图2所示.用带火星的木条检验,也能使带火星的木条复燃.
从上面的实验结果中,你能得到的结论是:收集到的氧气含量(或浓度)不足或含有水蒸气时,不易使带火星的木条复燃.
实验反思:实验结束后应先B.(填序号)
A.熄灭酒精灯 B.拔掉试管口上的单孔塞.
20.下列粒子结构示意图中,表示阳离子的是( )
0 156466 156474 156480 156484 156490 156492 156496 156502 156504 156510 156516 156520 156522 156526 156532 156534 156540 156544 156546 156550 156552 156556 156558 156560 156561 156562 156564 156565 156566 156568 156570 156574 156576 156580 156582 156586 156592 156594 156600 156604 156606 156610 156616 156622 156624 156630 156634 156636 156642 156646 156652 156660 211419
| A. |  | B. |  | C. |  | D. |  |
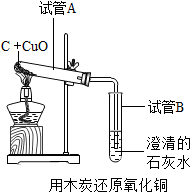 对于化学反应,我们不但要考虑加入的试剂,还要考虑环境中的其他物质对化学反应的影响.教材中“木炭还原氧化铜”的实验(见图).
对于化学反应,我们不但要考虑加入的试剂,还要考虑环境中的其他物质对化学反应的影响.教材中“木炭还原氧化铜”的实验(见图).