1.下列实验操作能达到实验目的是C
| 实验目的 | 实验操作 | |
| A | 鉴别烧碱和纯碱 | 取样,加入溶解,滴入无色酚酞 |
| B | 除去CaO中的CaCO3 | 加入适量的稀盐酸 |
| C | 验证蜡烛中含有H | 点燃,在火焰上方罩一个干冷的小烧杯 |
| D | 除去N2中的O2 | 通过灼热的铜网 |
20.下列气体不是空气污染物的是( )
| A. | 二氧化碳 | B. | 二氧化氮 | C. | 二氧化疏 | D. | 一氧化碳 |
18.辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质.工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如(图1)所示.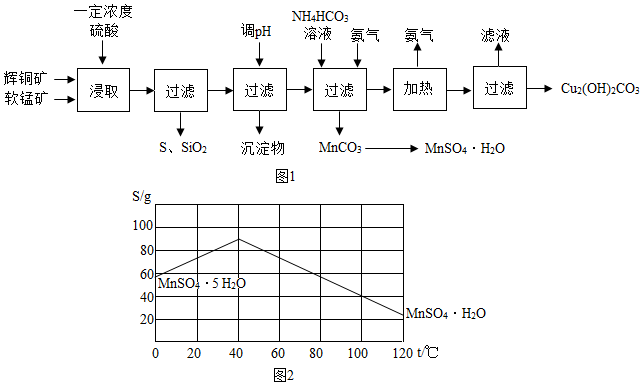
已知:①硫酸、MnO2与Cu2S反应生成硫酸铜、MnSO4和单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如表所示:
(1)酸浸时,为了提高浸取率可采取的措施有矿石粉碎或者适当升高温度或者搅拌(任写一点);酸浸过程中,硫酸、MnO2与Cu2S的化学反应方程式为2MnO2+Cu2S+4H2SO4=2CuSO4+S+4H2O+2MnSO4.
(2)调节浸出液pH的范围为1.1~3.2,其目的是使铁离子转化为氢氧化铁沉淀除去;
(3)本工艺中可循环使用的物质是NH3(写化学式).
(4)NH4HCO3溶液、氨气与MnSO4反应生成MnCO3和一种铵盐,且化学方程式为NH4HCO3+NH3+MnSO4=MnCO3↓+(NH4)2SO4;
(5)碳酸锰可转化为硫酸锰溶液,试根据(如图2)曲线图示,由硫酸锰溶液结晶出MnSO4•H2O的最低温度是
40℃;若由硫酸锰溶液结晶出MnSO4•5H2O的最佳温度是:0℃(上述两个温度均在图中所示范围内选取)
0 156436 156444 156450 156454 156460 156462 156466 156472 156474 156480 156486 156490 156492 156496 156502 156504 156510 156514 156516 156520 156522 156526 156528 156530 156531 156532 156534 156535 156536 156538 156540 156544 156546 156550 156552 156556 156562 156564 156570 156574 156576 156580 156586 156592 156594 156600 156604 156606 156612 156616 156622 156630 211419

已知:①硫酸、MnO2与Cu2S反应生成硫酸铜、MnSO4和单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如表所示:
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(2)调节浸出液pH的范围为1.1~3.2,其目的是使铁离子转化为氢氧化铁沉淀除去;
(3)本工艺中可循环使用的物质是NH3(写化学式).
(4)NH4HCO3溶液、氨气与MnSO4反应生成MnCO3和一种铵盐,且化学方程式为NH4HCO3+NH3+MnSO4=MnCO3↓+(NH4)2SO4;
(5)碳酸锰可转化为硫酸锰溶液,试根据(如图2)曲线图示,由硫酸锰溶液结晶出MnSO4•H2O的最低温度是
40℃;若由硫酸锰溶液结晶出MnSO4•5H2O的最佳温度是:0℃(上述两个温度均在图中所示范围内选取)


