18.用托盘天平称量5g药品,天平调平后,在称量过程中,发现指针向左偏转,此时应( )
| A. | 减少药品 | B. | 添加药品 | C. | 增加砝码 | D. | 调节平衡螺丝 |
17.鉴别氧气、空气、二氧化碳的最简单的方法是( )
| A. | 分别测定气体的密度 | B. | 分别伸入燃着的木条 | ||
| C. | 分别倒入澄清石灰水,振荡 | D. | 分别滴入紫色石蕊试剂,振荡 |
16.对下列实验现象的描述正确的是( )
| A. | 蜡烛在空气中燃烧生成二氧化碳和水 | |
| B. | 镁在空气中燃烧生成白色固体 | |
| C. | 红磷燃烧产生大量的白雾 | |
| D. | 细铁丝在空气中剧烈燃烧,火星四射 |
14. 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡.写出锌与盐酸发生反应的化学方程式为Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属活动性越强,反应越剧烈.
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积测得生成氢气的体积.
所用药品、实验数据如表:
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是其他条件相同时,盐酸浓度越大,反应越剧烈.
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】金属与盐酸反应的剧烈程度与金属表面积大小有关.
【实验方案】分别取等质量的锌片和锌粉于试管中,分别加入等体积等浓度的稀盐酸,观察产生气泡的快慢.(假设与方案要对应合理即可).
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡.写出锌与盐酸发生反应的化学方程式为Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属活动性越强,反应越剧烈.
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积测得生成氢气的体积.
所用药品、实验数据如表:
| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】金属与盐酸反应的剧烈程度与金属表面积大小有关.
【实验方案】分别取等质量的锌片和锌粉于试管中,分别加入等体积等浓度的稀盐酸,观察产生气泡的快慢.(假设与方案要对应合理即可).
13.下列三个表是我省某市不同时间空气质量日报的部分内容
表一
表二
表三
2005年2月17日夜晚下了一场在的“雨夹雪”,请根据季节、天气变化情况及表中提供的空气污染指数回答下列问题:
(1)与“表一”相比,“表二”中各项指数大幅度增加的直接原因是化石燃料的燃烧增多;
(2)与“表二”相比,“表三”中的二氧化硫和二氧化氮指数减少的原因是二氧化硫和二氧化氮溶于水;
一氧化碳的指数变化不大,说明一氧化碳一氧化碳难溶于水溶于水.
表一
| 2004年6月19日 |
| 二氧化硫 15 一氧化碳 22 二氧化氮 34 可吸入颗粒物 70 |
| 2005年2月17日 |
| 二氧化硫 68 一氧化碳 69 二氧化氮 65 可吸入颗粒物 98 |
| 2005年2月18日 |
| 二氧化硫 24 一氧化碳 67 二氧化氮 37 可吸入颗粒物 62 |
(1)与“表一”相比,“表二”中各项指数大幅度增加的直接原因是化石燃料的燃烧增多;
(2)与“表二”相比,“表三”中的二氧化硫和二氧化氮指数减少的原因是二氧化硫和二氧化氮溶于水;
一氧化碳的指数变化不大,说明一氧化碳一氧化碳难溶于水溶于水.
11.下列方法中,不能除去括号内的杂质的是( )
0 155589 155597 155603 155607 155613 155615 155619 155625 155627 155633 155639 155643 155645 155649 155655 155657 155663 155667 155669 155673 155675 155679 155681 155683 155684 155685 155687 155688 155689 155691 155693 155697 155699 155703 155705 155709 155715 155717 155723 155727 155729 155733 155739 155745 155747 155753 155757 155759 155765 155769 155775 155783 211419
| A. | 铜粉(铁粉) 除杂方法:加盐酸后,过滤 | |
| B. | 二氧化碳(一氧化碳) 除杂方法:通过澄清石灰水 | |
| C. | 硝酸钾(少量氯化钠) 除杂方法:加热溶解、冷却结晶 | |
| D. | 二氧化锰(炭粉) 除杂方法:加热、燃烧 |
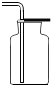
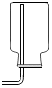

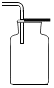
 在探究二氧化碳性质时如图所示实验
在探究二氧化碳性质时如图所示实验