19.用正确的化学符号填空:
| 名称 | 化学式 | 名称 | 化学式 |
| 2个碳酸分子 | 稀盐酸呈酸性的微粒 | ||
| 3个氢氧根离子 | 含有氮元素的碱 | ||
| 溶于水,溶液温度明显降低 | 作建筑材料,制玻璃的物质 | ||
| 因发生物理变化溶液质量增大 | 地壳中含量最多的金属 |
18.下列实验方案不能达到预期目的是( )
0 155374 155382 155388 155392 155398 155400 155404 155410 155412 155418 155424 155428 155430 155434 155440 155442 155448 155452 155454 155458 155460 155464 155466 155468 155469 155470 155472 155473 155474 155476 155478 155482 155484 155488 155490 155494 155500 155502 155508 155512 155514 155518 155524 155530 155532 155538 155542 155544 155550 155554 155560 155568 211419
| A. | 鉴别棉线与羊毛绒-灼烧闻气味 | |
| B. | 除去氧化钙中的碳酸钙-高温煅烧 | |
| C. | 区分氯化铵与氯化钠-加熟石灰 | |
| D. | 检验氢氧化钠溶液是否变质-滴入酚酞溶液 |

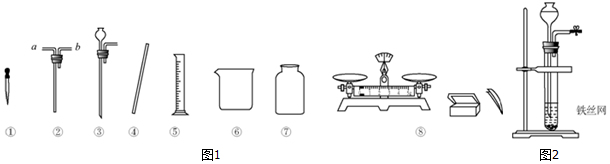
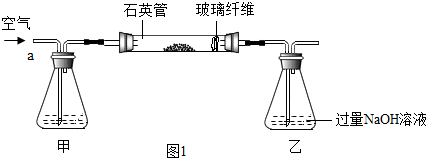


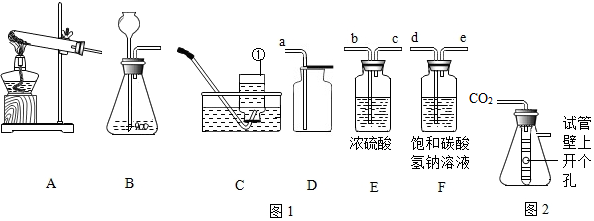
 通过化学学习,同学们对物质的组成和结构有了一定的了解.
通过化学学习,同学们对物质的组成和结构有了一定的了解.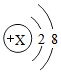 ,则X=8.
,则X=8.