8.善于梳理和归纳有利于知识的系统化,以下归纳完全正确的一组是( )
| A、化学家与化学发展贡献 | B、化学反应类型 |
| 拉瓦锡最早验证了空气的成分 门捷列夫发现了元素周期律 | 是氧化反应一定是化合反应 高锰酸钾受热分解属于分解反应 |
| C、物质的分类 | D、物质的性质与用途 |
| 冰水混合物混合物 净化后的空气纯净物 | 氮气常温下化学性质稳定焊接金属的保护气 稀有气体化学性质稳定制造各种用途的电光源 |
| A. | A | B. | B | C. | C | D. | D |
7.人类认识化学并使之成为一门科学,经历了漫长的过程.创立奠定近代化学基础的是( )
| A. | 会制造劳动工具 | B. | 发现和利用了火 | ||
| C. | 原子论和分子论的创立 | D. | 元素周期律和元素周期表的发现 |
6.化学的发展对改善人们的生存环境和促进社会发展有着积极的作用,下列各项利用化学变化与其所达到的目的不相符的是( )
| 选项 | 化学变化 | 目的 |
| A | 合成医药 | 抑制细菌和病毒,改善人体健康 |
| B | 生产化肥、农药 | 增加粮食产量 |
| C | 开发新材料、新能源 | 改善生存条件,提高生活质量 |
| D | 合成食品添加剂 | 增进人体健康 |
| A. | A | B. | B | C. | C | D. | D |
5.化学是在原子、分子层次上研究物质的:①组成; ②结构; ③性质; ④变化规律.你认为其中正确的是( )
| A. | 只有①② | B. | 只有①③ | C. | 只有②④ | D. | 全部正确 |
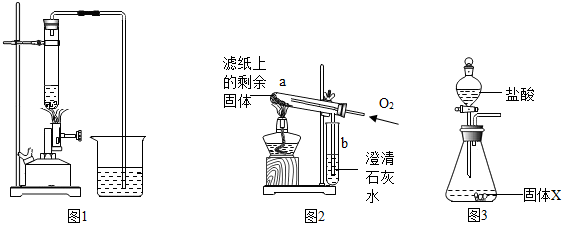
4.研究小组进行木炭还原氧化铁的探究活动.将木炭、氧化铁及试管充分烘干,并将木炭和氧化铁混合均匀、研磨.取适量上述混合物于试管中,用右图1所示的装置加热(试管竖直向上,可使加热时的热量尽少散失).
【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁.铁的部分氧化物的性质如下:
Fe3O4具有很好的磁性,能被磁铁吸引.铁的三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl══2FeCl3+3H2O
Fe3O4+8HCl══2FeCl3+FeCl2+4H2O
FeO+2HCl══FeCl2+H2O
黄色的FeCl3溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验FeCl3;FeCl3溶液遇单质铁发生反应:2FeCl3+Fe=3FeCl2,溶液变为浅绿色.
【猜想】固体X可能含有:①Fe ②FeO ③Fe3O4 ④Fe2O3(写化学式) ⑤C
【实施实验】
目的:确定固体X的组成.
【反思改进】
同学们讨论发现,用上述实验方法不能确定固体X中一定没有Fe3O4,理由是固体X中如果含有Fe3O4,步骤V中加盐酸后,由于铁与FeCl3反应生成FeCl2,遇KSCN溶液也不变血红色.
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
【获得结论】
(1)为确定固体X中是否含Fe3O4,m1~m4中应该用到的数据有m1、m2、m3和m4.
(2)固体X各成分的质量比为11:168.
【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】

铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁.铁的部分氧化物的性质如下:
Fe3O4具有很好的磁性,能被磁铁吸引.铁的三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl══2FeCl3+3H2O
Fe3O4+8HCl══2FeCl3+FeCl2+4H2O
FeO+2HCl══FeCl2+H2O
黄色的FeCl3溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验FeCl3;FeCl3溶液遇单质铁发生反应:2FeCl3+Fe=3FeCl2,溶液变为浅绿色.
【猜想】固体X可能含有:①Fe ②FeO ③Fe3O4 ④Fe2O3(写化学式) ⑤C
【实施实验】
目的:确定固体X的组成.
| 步骤 | 操作 | 主要现象 | 结论 |
| I | 取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引. | 部分固体被吸引到磁铁上 | 可能有Fe或Fe3O4 |
| II | 取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热. | 固体剧烈燃烧,b中溶液变浑浊 | 一定有C. |
| III | 另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸. | 无明显现象 | 一定没有FeO和Fe2O3 . |
| IV | 取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸. | 产生产生气泡. | 一定有Fe |
| V | 在步骤IV所得溶液中逐滴加入KSCN溶液. | 溶液不变红色 | 一定没有Fe3O4 |
同学们讨论发现,用上述实验方法不能确定固体X中一定没有Fe3O4,理由是固体X中如果含有Fe3O4,步骤V中加盐酸后,由于铁与FeCl3反应生成FeCl2,遇KSCN溶液也不变血红色.
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
| 步骤 | 操作 | 数据 |
| I | 重新取部分冷却至室温的固体X,称量其质量为m1. | m1=17.9g |
| II | 将称量好的固体X全部放入图3所示的锥形瓶中,称量整套装置及药品的质量为m2;打开分液漏斗旋塞,放入足量稀盐酸后关闭旋塞,待没有气泡产生并恢复至室温,再次称量整套装置及药品的质量为m3. | m2=317.9g m3=317.3g |
| III | 将锥形瓶中剩余的固体过滤、洗涤并干燥,称量其质量为m4. | m4=1.1g |
(1)为确定固体X中是否含Fe3O4,m1~m4中应该用到的数据有m1、m2、m3和m4.
(2)固体X各成分的质量比为11:168.
20. 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法正确的是( )
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法正确的是( )
 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法正确的是( )
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法正确的是( )| A. | a点溶液中的溶质有2种 | |
| B. | b点溶液是无色的 | |
| C. | c点得到的固体为两种 | |
| D. | 取d点的固体,加入稀盐酸,无气泡产生 |
19.下列实验操作能达到实验目的是( )
0 153415 153423 153429 153433 153439 153441 153445 153451 153453 153459 153465 153469 153471 153475 153481 153483 153489 153493 153495 153499 153501 153505 153507 153509 153510 153511 153513 153514 153515 153517 153519 153523 153525 153529 153531 153535 153541 153543 153549 153553 153555 153559 153565 153571 153573 153579 153583 153585 153591 153595 153601 153609 211419
| 选项 | 实验目的 | 实验操作 |
| A | 除去混入氧气中的氮气 | 通过炽热的铜网 |
| B | 检验二氧化碳中含有少量的一氧化碳 | 点燃 |
| C | 除去木炭粉中的氧化铜 | 在空气中灼烧 |
| D | 除去FeSO4溶液中的CuSO4 | 加入足量铁粉,过滤 |
| A. | A | B. | B | C. | C | D. | D |
 已知A、B、C、D、E五种物质中均含有某种相同的非金属元素,常温下A为气态单质,B为无色液体,C为黑色固体.图中“→”表示物质之间的转化关系.五种物质的转化关系如图所示(图中反应条件及部分反应物或生成物省略).
已知A、B、C、D、E五种物质中均含有某种相同的非金属元素,常温下A为气态单质,B为无色液体,C为黑色固体.图中“→”表示物质之间的转化关系.五种物质的转化关系如图所示(图中反应条件及部分反应物或生成物省略).
