11. 鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.
鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.
【猜想】小红认为:只含氢氧化钠;
小明认为:含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:含有氢氧化钠和碳酸钠;
小华认为:含有氢氧化钠和氢氧化钙
【讨论】你认为小红、小明、小亮、小华四位同学中的猜想不合理,请说明理由小明; Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(用化学方程式表示).
【实验分析】小亮同学针对自己的猜想进行了如下实验:
你认为小亮同学对实验结果判断是否正确?不正确(填“正确”或“不正确”),请说明理由盐酸不足,盐酸和氢氧化钠反应后,没有剩余盐酸与碳酸钠反应.
 鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.
鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.【猜想】小红认为:只含氢氧化钠;
小明认为:含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:含有氢氧化钠和碳酸钠;
小华认为:含有氢氧化钠和氢氧化钙
【讨论】你认为小红、小明、小亮、小华四位同学中的猜想不合理,请说明理由小明; Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(用化学方程式表示).
【实验分析】小亮同学针对自己的猜想进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | 自己的猜想不成立 |
10.铁与水蒸气能发生反应生成一种常见铁的氧化物和一种气体.某化学学习小组的同学对此反应很感兴趣,在小组集体协作下设计了如图实验,以探究铁粉与水蒸气反应后的产物,也邀请你一起来完成下列探究:
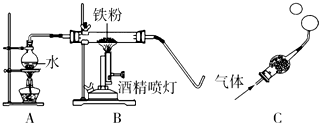
(1)A装置的作用是 ①提供水蒸气.
(2)探究生成的气体是什么?
【猜想与假设】猜想一:生成的气体可能是氢气;猜想二:生成的气体可能是氧气.
【实验探究】将生成的气体通入球形管里装有碱石灰干燥剂.导管口蘸些肥皂水(或洗涤剂溶液),控制气体流速,吹出肥皂泡.当肥皂泡吹到一定大时,轻轻摆动导管,肥皂泡脱离管口后,气泡上升.用燃着的木条靠近肥皂泡,有爆鸣声.
【推断】生成的气体是②氢气.
(3)探究试管中剩余固体成分是什么?
【查阅资料】
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引.
【猜想与假设】猜想一:剩余固体是Fe和Fe3O4;猜想二:剩余固体是 ③Fe3O4.
【实验探究】
【实验结论】铁与水蒸气反应的化学方程式为:⑥3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
【反思与交流】该黑色固体不可能是FeO、Fe2O3,理由是 ⑦FeO不能被磁铁吸引,Fe2O3红棕色粉末且不能被磁铁吸引.

(1)A装置的作用是 ①提供水蒸气.
(2)探究生成的气体是什么?
【猜想与假设】猜想一:生成的气体可能是氢气;猜想二:生成的气体可能是氧气.
【实验探究】将生成的气体通入球形管里装有碱石灰干燥剂.导管口蘸些肥皂水(或洗涤剂溶液),控制气体流速,吹出肥皂泡.当肥皂泡吹到一定大时,轻轻摆动导管,肥皂泡脱离管口后,气泡上升.用燃着的木条靠近肥皂泡,有爆鸣声.
【推断】生成的气体是②氢气.
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
| 能否与盐酸反应 | 能 | 能 | 能 |
【猜想与假设】猜想一:剩余固体是Fe和Fe3O4;猜想二:剩余固体是 ③Fe3O4.
【实验探究】
| 实验操作 | 实验现象及结论 |
| ④取少量黑色固体于试管中,加入足量的稀盐酸 | ⑤若固体全部溶解,没有气泡冒出,则猜想二正确;若固体全部溶解,有气泡冒出,则猜想一正确 |
【反思与交流】该黑色固体不可能是FeO、Fe2O3,理由是 ⑦FeO不能被磁铁吸引,Fe2O3红棕色粉末且不能被磁铁吸引.
7.化学小组同学在课外读物中看到:“通常CO2可作灭火剂,但有些物质(如Na)着火,不能用CO2熄灭.”他们决定探究CO2与Na反应的产物.
【提出猜想】CO2与Na反应可能生成4种物质:C、CO、Na2O、Na2CO3.
【查阅资料】
①Na是非常活泼的金属,常温下与O2、H2O等物质反应.
②碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应.
③Na2O是白色固体,与H2O反应生成NaOH.
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀.
【实验过程】同学们在老师的指导下设计了如图所示装置(部分夹持仪器已略去)

(1)实验记录
(2)实验反思
①实验记录②中,E中出现浑浊,再点燃酒精灯的目的是排出装置中的空气,防止空气的干扰.
②装置B中发生的反应的化学方程式是NaHCO3+HCl═NaCl+H2O+CO2↑,若无装置C,对实验有影响的物质是水.
③检验第4种反应产物是否存在的实验方案:取D中白色固体于试管中,加水溶解,加水完全溶解,加入过量CaCl2溶液至不再产生沉淀,滴加酚酞试液,溶液呈红色.说明白色固体中含Na2O.
(3)数据分析:若在实验过程中至少需要8.8g二氧化碳参加反应,则最少需要含杂质20%的石灰石的质量是多少?(写出计算过程)
【提出猜想】CO2与Na反应可能生成4种物质:C、CO、Na2O、Na2CO3.
【查阅资料】
①Na是非常活泼的金属,常温下与O2、H2O等物质反应.
②碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应.
③Na2O是白色固体,与H2O反应生成NaOH.
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀.
【实验过程】同学们在老师的指导下设计了如图所示装置(部分夹持仪器已略去)

(1)实验记录
| 序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
| ① | 打开a,关闭b,由长颈漏斗注入浓盐酸 | A中产生大量气泡 E中出现浑浊 | E中反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体 G中产生黑色沉淀 | 反应产物一定有C和CO |
| ③ | 取D中白色固体于试管中,加水溶解,再加入石灰水 | 产生白色沉淀 | 反应产物还有Na2CO3 |
①实验记录②中,E中出现浑浊,再点燃酒精灯的目的是排出装置中的空气,防止空气的干扰.
②装置B中发生的反应的化学方程式是NaHCO3+HCl═NaCl+H2O+CO2↑,若无装置C,对实验有影响的物质是水.
③检验第4种反应产物是否存在的实验方案:取D中白色固体于试管中,加水溶解,加水完全溶解,加入过量CaCl2溶液至不再产生沉淀,滴加酚酞试液,溶液呈红色.说明白色固体中含Na2O.
(3)数据分析:若在实验过程中至少需要8.8g二氧化碳参加反应,则最少需要含杂质20%的石灰石的质量是多少?(写出计算过程)
6.同学们用高锰酸钾制氧气,制取结束清洗仪器时,发现加热高锰酸钾的试管内壁有用试管刷刷不掉的黑色固体.
问题一:黑色固体是什么?
【交流讨论】同学们结合实验现象和对高锰酸钾及其分解产物的了解,进行分析判断.
【实验验证】向未洗净的试管中加入某种液体,产生能使带火星木条复燃的气体,证明上述判断正确,加入的液体是过氧化氢溶液.
问题二:用什么冼掉MnO2?
【交流讨论】MnO2与BaCO3、Mg(OH)2、Fe2O3、P2O5、Cu中的某一种物质组成最相近,理由是都是金属氧化物.这种物质能与稀盐酸反应,化学方程式为Fe2O3+6HCl=3H2O+2FeCl3,由此推测MnO2有什么化学性质,用什么试剂清洗呢?同学们请教老师后决定用草酸(H2C2O4)溶液试一试.
【实验验证】向未洗净的试管中加入草酸溶液,黑色固体果然被除去,同时产生许多气泡.
【反思提高】以上探究活动中,清除试管内壁附着的难溶物的思路是:先了解其物理性质,尤其是否溶于水,再了解其化学性质,然后选择例行试剂进行清洗.
问题一:黑色固体是什么?
【交流讨论】同学们结合实验现象和对高锰酸钾及其分解产物的了解,进行分析判断.
| 判 断 | 依 据 |
| 不是KMnO4 | KMnO4能溶于水形成紫红色溶液 |
| 不是K2MnO4(填化学式) | 冲洗试管时出现深绿色溶液,说明该物质能溶于水 |
| 是MnO2 | 其他实验用过MnO2,知道它是不溶于水的黑色固体 |
问题二:用什么冼掉MnO2?
【交流讨论】MnO2与BaCO3、Mg(OH)2、Fe2O3、P2O5、Cu中的某一种物质组成最相近,理由是都是金属氧化物.这种物质能与稀盐酸反应,化学方程式为Fe2O3+6HCl=3H2O+2FeCl3,由此推测MnO2有什么化学性质,用什么试剂清洗呢?同学们请教老师后决定用草酸(H2C2O4)溶液试一试.
【实验验证】向未洗净的试管中加入草酸溶液,黑色固体果然被除去,同时产生许多气泡.
【反思提高】以上探究活动中,清除试管内壁附着的难溶物的思路是:先了解其物理性质,尤其是否溶于水,再了解其化学性质,然后选择例行试剂进行清洗.
4.请根据表回答有关问题:
(1)表中的物质属于氧化物的是②.属于碱的是③;属于盐的是④.
(2)利用表中的物质作为反应物,写出符合下列要求的化学方程式.
①电解水2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
②熟石灰和纯碱反应Na2CO3+Ca(OH)2═2NaOH+CaCO3↓.
(3)若要测定纯碱溶液的酸碱度,可选用下列选项中的③.
①无色酚酞试液 ②紫色石蕊试液 ③pH试纸
(4)槟榔芋皮上含有一种碱性的物质--皂角素,皮肤沾上它会奇痒难忍.你认为可选用下列①来涂抹止痒.
①食醋(含醋酸) ②熟石灰 ③纯碱.
| 序号 | ① | ② | ③ | ④ |
| 物质 | 醋酸 | 水 | 熟石灰 | 纯碱 |
| 化学式 | CH3COOH | H2O | Ca(OH)2 | Na2CO3 |
(2)利用表中的物质作为反应物,写出符合下列要求的化学方程式.
①电解水2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
②熟石灰和纯碱反应Na2CO3+Ca(OH)2═2NaOH+CaCO3↓.
(3)若要测定纯碱溶液的酸碱度,可选用下列选项中的③.
①无色酚酞试液 ②紫色石蕊试液 ③pH试纸
(4)槟榔芋皮上含有一种碱性的物质--皂角素,皮肤沾上它会奇痒难忍.你认为可选用下列①来涂抹止痒.
①食醋(含醋酸) ②熟石灰 ③纯碱.
2. 食品包装中常使用一种袋装为“504双吸剂”防腐剂,标签如图所示.作用:防潮、防氧化.双吸剂变质失效后,固体中大部分是灰白色的,少许是红棕色的.甲、乙、丙三位同学对一包久置的“双吸剂”的变质情况进行探究.
食品包装中常使用一种袋装为“504双吸剂”防腐剂,标签如图所示.作用:防潮、防氧化.双吸剂变质失效后,固体中大部分是灰白色的,少许是红棕色的.甲、乙、丙三位同学对一包久置的“双吸剂”的变质情况进行探究.
【提出问题】变质后,固体成分中有什么物质?颜色有什么变化?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁,氧化铁粉为红棕色.
【作出猜想】变质后的固体成分中可能含有:Fe、CaO、Fe2O3、Ca(OH)2、CaCO3.
【分析猜想】根据“双吸剂”的作用:防潮、防氧化.由此说明“双吸剂”成分中的物质可吸收水和氧气两种物质,从而可防止食品腐败.
【实验探究】三位同学的探究方案如下表.
【反思应用】
(1)综合上述探究,请分析甲、乙、丙的实验结论中,不合理的是甲、乙.
(2)采取什么实验方法可以使失效后的红棕色粉末“还原”?(用化学方程式表示)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
0 150444 150452 150458 150462 150468 150470 150474 150480 150482 150488 150494 150498 150500 150504 150510 150512 150518 150522 150524 150528 150530 150534 150536 150538 150539 150540 150542 150543 150544 150546 150548 150552 150554 150558 150560 150564 150570 150572 150578 150582 150584 150588 150594 150600 150602 150608 150612 150614 150620 150624 150630 150638 211419
 食品包装中常使用一种袋装为“504双吸剂”防腐剂,标签如图所示.作用:防潮、防氧化.双吸剂变质失效后,固体中大部分是灰白色的,少许是红棕色的.甲、乙、丙三位同学对一包久置的“双吸剂”的变质情况进行探究.
食品包装中常使用一种袋装为“504双吸剂”防腐剂,标签如图所示.作用:防潮、防氧化.双吸剂变质失效后,固体中大部分是灰白色的,少许是红棕色的.甲、乙、丙三位同学对一包久置的“双吸剂”的变质情况进行探究.【提出问题】变质后,固体成分中有什么物质?颜色有什么变化?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁,氧化铁粉为红棕色.
【作出猜想】变质后的固体成分中可能含有:Fe、CaO、Fe2O3、Ca(OH)2、CaCO3.
【分析猜想】根据“双吸剂”的作用:防潮、防氧化.由此说明“双吸剂”成分中的物质可吸收水和氧气两种物质,从而可防止食品腐败.
【实验探究】三位同学的探究方案如下表.
| 实验操作 | 实验现象 | 实验结论 |
| 甲:取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时触摸试管外壁,感觉发烫,试管底部有不溶物,溶液变红色. | 甲:固体中一定含有CaO和Ca(OH)2 |
| 乙:另取少量固体放于试管中,滴加足量的稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 乙:固体中一定含有铁,一定不含有Fe2O3 |
| 丙:将乙产生的气体通入到澄清石灰水中 | 澄清石灰水中变浑浊 | 丙:固体中一定含有CaCO3 |
(1)综合上述探究,请分析甲、乙、丙的实验结论中,不合理的是甲、乙.
(2)采取什么实验方法可以使失效后的红棕色粉末“还原”?(用化学方程式表示)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.


