19. 物质A和物质B(构成它们的微粒分别用“□”和“○”表示)的反应如图所示,对该反应的描述,下列反应方程正确的是( )
物质A和物质B(构成它们的微粒分别用“□”和“○”表示)的反应如图所示,对该反应的描述,下列反应方程正确的是( )
 物质A和物质B(构成它们的微粒分别用“□”和“○”表示)的反应如图所示,对该反应的描述,下列反应方程正确的是( )
物质A和物质B(构成它们的微粒分别用“□”和“○”表示)的反应如图所示,对该反应的描述,下列反应方程正确的是( )| A. | A+2B=AB2 | B. | 3A+6B=A3B6 | C. | 3A+8B=3AB2+2B | D. | 3A+8B=A3B8 |
18.寒冷的冬季流行的“暖宝宝”--即一次性使用取暖片,只要取出直接贴在衣服上.可持续温暖12小时.小明查看说明书,发现内袋物质成分为铁粉、水、活性炭、食盐等,
外袋材料:不透气塑料,小明猜想“暖宝宝”发出的热量可能来自于铁粉氧化(即生锈).于是设计了如下实验,请你帮助小明完成表中的内容.
[设计实验]
[得出结论]“暖宝宝”发出的热量主要来自铁粉发生氧化(生锈)的过程.
外袋材料:不透气塑料,小明猜想“暖宝宝”发出的热量可能来自于铁粉氧化(即生锈).于是设计了如下实验,请你帮助小明完成表中的内容.
[设计实验]
| 实验操作 | 实验现象 | 解释或结论 | |
| 步骤1 | 取A、B两袋“暖宝宝”,A袋打开外袋取出内袋;B袋不打开外袋,放置在同样的环境中. | A袋“暖宝宝”温度很快上升;B袋温度没有明显变化 | “暖宝宝”发热是由于袋内物质与空气接触. |
| 步骤2 | 一天后,从上述A、B两袋中各取少量袋内物质于两支试管中,分别加入适量稀盐酸. | A袋内物质部分溶解,溶液呈黄色(已知铁锈和稀盐酸反应后溶液变黄); B袋内物质部分溶解,产生(1)气泡,溶液变成浅绿色. | A袋内物质的铁已经转化为(2)铁锈. B袋内该物质与稀盐酸反应的化学方程式为:(3)Fe+2HCl═FeCl2+H2↑. |
13.下列除去杂质的方法正确的是( )
| A. | 除去N2中的少量O2:通过灼热的CuO粉末,收集气体 | |
| B. | 除硝酸钾溶液中少量硝酸钡:加入过量硫酸钾溶液,过滤后溶液中补加适量硝酸 | |
| C. | 除去Cu(NO3)2溶液中的少量AgNO3:加入足量铜粉,充分反应后过滤 | |
| D. | 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 |
12.小明同学为了寻找含碳酸钙质量分数超过85%的石灰石,对一样品进行了如表定量实验.
已知烧杯质量为13.1g,试通过计算分析:
(1)该试验中生成的二氧化碳的质量是4.4g.
(2)通过计算推断该是石灰石样品的纯度是否符合要求(石灰石样品中的杂质不与盐酸反应)?反应所得溶液的溶质质量分数是多少?(要求写出计算步骤)
0 149961 149969 149975 149979 149985 149987 149991 149997 149999 150005 150011 150015 150017 150021 150027 150029 150035 150039 150041 150045 150047 150051 150053 150055 150056 150057 150059 150060 150061 150063 150065 150069 150071 150075 150077 150081 150087 150089 150095 150099 150101 150105 150111 150117 150119 150125 150129 150131 150137 150141 150147 150155 211419
| 实验步骤 | Ⅰ.将适量盐酸加入烧杯中并称重 | Ⅱ.称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | Ⅲ.待反应完全后,称重 |
| 实验图示 |  | ||
| 实验数据 | 烧杯和盐酸的质量为100.0g | 石灰石样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
(1)该试验中生成的二氧化碳的质量是4.4g.
(2)通过计算推断该是石灰石样品的纯度是否符合要求(石灰石样品中的杂质不与盐酸反应)?反应所得溶液的溶质质量分数是多少?(要求写出计算步骤)

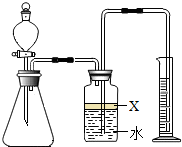 氮化铝(AlN)是一种新型材料.某氮化铝样品中含有碳或氧化铝杂质,已知氮化铝和NaOH溶液能反应,其反应方程式为①AlN+NaOH+H2O=NaAlO2+NH3↑②氧化铝也能与氢氧化钠溶液反应而全部溶解,但不生成气体.现用如图所示中的一些装置来进行相关实验.根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计).
氮化铝(AlN)是一种新型材料.某氮化铝样品中含有碳或氧化铝杂质,已知氮化铝和NaOH溶液能反应,其反应方程式为①AlN+NaOH+H2O=NaAlO2+NH3↑②氧化铝也能与氢氧化钠溶液反应而全部溶解,但不生成气体.现用如图所示中的一些装置来进行相关实验.根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计).