10.将10%的氨水与20%的氨水等体积混合时溶质质量分数( )
| A. | 15% | B. | >15% | C. | <15% | D. | 上述情况均可能 |
9.下列实验操作正确的是( )
| A. | 未说明药品用量时,液体取5mL左右,固体只需盖满试管底部 | |
| B. | 用滴管滴加液体时,为防止液滴飞溅应将滴管口紧贴试管内壁 | |
| C. | 酒精灯用完后,立即用嘴吹灭,并盖上灯帽,以防酒精挥发,下次使用时易点燃 | |
| D. | 玻璃仪器内壁附着的水既不聚成水滴,也不成股流下时,表示仪器洗涤干净 |
8.铜是人类普遍使用最早的金属.我们的祖先一开始使用的是纯铜,即红铜.红铜之后,发展到使用铜锡合金的青铜.青铜熔点比红铜低,硬度大,而且又比较耐腐蚀,而我国的锡储量占世界第一位.古代记载的炼锡方法基本上就是现代用的碳还原法,该反应的化学方程式为:SnO2+2C$\frac{\underline{\;高温\;}}{\;}$Sn+2CO↑.该反应类型属于( )
| A. | 复分解反应 | B. | 置换反应 | C. | 分解反应 | D. | 化合反应 |
6.以下几种实验操作,不正确的是( )
| A. | 酒精灯失火用湿抹布扑盖 | B. | 将NaCl倒入量筒中配制溶液 | ||
| C. | 用闻气味的方法区别物质 | D. | 分离溶液析出的KNO3晶体 |
2.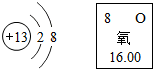 元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
(1)根据如图信息,写出甲、乙两种元素的单质间发生反应的化学方程式:4Al+3O2=2Al2O3.
(2)某同学将铁片放入CuSO4溶液中,发现铁片表面有红色物质析出,同时还有少量无色无味气泡产生.对于产生气泡的“异常现象”,下列猜想不合理的是B(填字母).
A、产生的气体可能是H2 B、产生的气体可能是CO2
C、CuSO4溶液中可能含有少量的某种酸 D、CuSO4溶液的pH可能小于7
(3)某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”,某研究性学习小组对该厂生产的烧碱样品进行如下探究.
【提出问题】烧碱样品中含有哪些杂质?
【猜想】
猜想一:可能含有Na2CO3,作出此猜想的依据是:CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
猜想二:可能含有NaCl,作出此猜想的依据是:可能有少量的氯化钠没有反应(用简洁的文字表述).
【设计实验】
(4)某同学取100g含有H2SO4的酸性废水,然后滴加烧碱溶液中和,至溶液pH=7时,共消耗质量分数为20%的烧碱溶液20g.求这种废水中含H2SO4的质量分数.
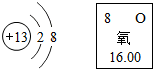 元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.(1)根据如图信息,写出甲、乙两种元素的单质间发生反应的化学方程式:4Al+3O2=2Al2O3.
(2)某同学将铁片放入CuSO4溶液中,发现铁片表面有红色物质析出,同时还有少量无色无味气泡产生.对于产生气泡的“异常现象”,下列猜想不合理的是B(填字母).
A、产生的气体可能是H2 B、产生的气体可能是CO2
C、CuSO4溶液中可能含有少量的某种酸 D、CuSO4溶液的pH可能小于7
(3)某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”,某研究性学习小组对该厂生产的烧碱样品进行如下探究.
【提出问题】烧碱样品中含有哪些杂质?
【猜想】
猜想一:可能含有Na2CO3,作出此猜想的依据是:CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
猜想二:可能含有NaCl,作出此猜想的依据是:可能有少量的氯化钠没有反应(用简洁的文字表述).
【设计实验】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁 | 试管外壁发热 | 原因是氢氧化钠固体溶于水放热 |
| ②向①所得的溶液中逐渐加入稀硝酸至过量 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体 | 样品中含有的杂质是碳酸钠 |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂质是氯化钠 |
1. 元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
(1)根据如图信息,写出甲、乙两种元素的单质间发生反应的化学方程式:4Al+3O2=2Al2O3.
(2)某同学将铁片放入CuSO4溶液中,发现铁片表面有红色物质析出,同时还有少量无色无味气泡产生.对于产生气泡的“异常现象”,下列猜想不合理的是B(填字母).
A.产生的气体可能是H2 B.产生的气体可能是CO2
C.CuSO4溶液中可能含有少量的某种酸 D.CuSO4溶液的pH可能小于7
(3)某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”.某研究性学习小组对该厂生产的烧碱样品进行如下研究.
【提出问题】烧碱样品中可能含有哪些杂质?
【猜想】
猜想一:可能含有Na2CO3.作出此猜想的依据是CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
猜想二:可能含有NaCl.作出此猜想的依据是可能有少量的氯化钠没有反应(用简洁的文字表示).
【实验设计】
(4)某同学取100g含有H2SO4的酸性废水,然后滴加烧碱溶液中和,至溶液pH=7时,共消耗质量分数为20%的烧碱溶液20g.求这种废水中含H2SO4的质量分数.
0 149944 149952 149958 149962 149968 149970 149974 149980 149982 149988 149994 149998 150000 150004 150010 150012 150018 150022 150024 150028 150030 150034 150036 150038 150039 150040 150042 150043 150044 150046 150048 150052 150054 150058 150060 150064 150070 150072 150078 150082 150084 150088 150094 150100 150102 150108 150112 150114 150120 150124 150130 150138 211419
 元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.(1)根据如图信息,写出甲、乙两种元素的单质间发生反应的化学方程式:4Al+3O2=2Al2O3.
(2)某同学将铁片放入CuSO4溶液中,发现铁片表面有红色物质析出,同时还有少量无色无味气泡产生.对于产生气泡的“异常现象”,下列猜想不合理的是B(填字母).
A.产生的气体可能是H2 B.产生的气体可能是CO2
C.CuSO4溶液中可能含有少量的某种酸 D.CuSO4溶液的pH可能小于7
(3)某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”.某研究性学习小组对该厂生产的烧碱样品进行如下研究.
【提出问题】烧碱样品中可能含有哪些杂质?
【猜想】
猜想一:可能含有Na2CO3.作出此猜想的依据是CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
猜想二:可能含有NaCl.作出此猜想的依据是可能有少量的氯化钠没有反应(用简洁的文字表示).
【实验设计】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁试 | 管外壁发热 | 原因是氢氧化钠固体溶于水放热 |
| ②向①所得的溶液中逐滴加入稀硝酸至过量 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体 | 样品中含有的杂质是碳酸钠 |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还还有的杂质是氯化钠 |
 你玩过拼图吗?以下拼图分别代表Fe、CO2、
你玩过拼图吗?以下拼图分别代表Fe、CO2、 如图是A、B、C三种物质的溶解度曲线,据图回答:
如图是A、B、C三种物质的溶解度曲线,据图回答: